Cis-trans-isomeria
Cis-trans-isomeria on geometrisen isomerian ja stereoisomerian muoto, jolla kuvataan atomien tai atomiryhmien suuntautumista molekyylissä. Cis-trans-isomeriaa esiintyy kaksoissidoksellisilla (alkeeneilla) ja syklisillä (rengasrakenteisilla) yhdisteillä.[1]
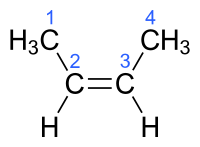

Orgaanisten molekyylien C–C-kaksoissidos ei salli vapaata kiertymistä sidosakselin ympäri. Kaksoissidoksen muodostaviin hiiliin liittyvät atomit tai atomiryhmät joutuvat siten eri asemaan toisiinsa ja kaksoissidokseen nähden. Jos molemmissa kaksoissidoksen muodostamissa hiilissä on kiinnittyneenä jokin muu atomi tai atomiryhmä kuin vety, voivat ne sijaita kaksoissidokseen nähden samalla puolella (cis-isomeeri) tai eri puolilla (trans-isomeeri).[1] Tätä isomerian lajia kutsutaan cis-trans-isomeriaksi. Kun substituentteja on enemmän kuin kaksi, käytetään E,Z-nimeämistapaa (E,Z-isomeria). Rengasrakenteisilla yhdisteillä cis-isomeerissä substituentit ovat samalla puolella renkaan muodostamaa tasoa ja trans-isomeerissä eri puolilla[1].
Reaktiivisuus
muokkaaKaksoissidoksissa cis- ja trans-asemista trans-konfiguraatio on termodynaamisesti stabiilimpi, toisin sanoen jos sidos saisi vapaasti kiertyä, se asettuisi suurimmaksi osaksi trans-muotoon, korkeamman energian cis-muodon jäädessä pienemmälle osuudelle. Kiertymiselle on kuitenkin oltava mekanismi; se ei tapahdu itsestään. Sidos voi kiertyä esimerkiksi sivureaktiona nikkelikatalyytin vaikutuksesta cis-rasvahappoja hydrattaessa, jolloin syntyy sivutuotteena transrasvoja. Toinen cis-trans-isomeereja tasapainottava reaktiotyyppi on valon aiheuttama kaksoissidoksen hajoaminen kahden radikaalikeskuksen väliseksi yksinkertaiseksi sidokseksi, joka voi kiertyä ja palata kaksoissidostilaan trans-muodossa. Esimerkiksi retinaali on silmän hämäränäkösolujen rodopsiinipigmentin aktiivinen osa, joka isomeroituu cis-muodosta trans-muotoon, kun valo osuu siihen. Trans-retinaali ei enää sovi rodopsiinireseptoriin ja irtoaa, mikä käynnistää hermoimpulssin lähettämiseen johtavan tapahtumaketjun.
Termodynaaminen stabiilius ei kuitenkaan tarkoita, että trans-muoto olisi välttämättä suosituin kaikissa reaktioissa. Esimerkkinä on prosessi, jossa trans-muoto absorboi valoa paremmin kuin cis-muoto, ja valon vaikutuksesta kaksoissidos hajoaa yksinkertaiseksi sidokseksi radikaalireaktiolla, kiertyy cis-muotoon ja sitoutuu uudelleen kaksoissidokseksi. Prosessia voi käyttää preparatiivisesti.
Riippuu yhdisteestä, miten cis-trans-isomeria tarkalleen vaikuttaa aineen ominaisuuksiin. 2-penteenin isomeerien kiehumispiste eroaa vain yhdellä asteella, kun taas fumaarihappo (trans-muoto) ja maleiinihappo (cis-muoto) ovat niin erilaisia ominaisuuksiltaan, ettei niitä alun perin edes tunnistettu lähes samanlaisiksi aineiksi.
Avaruudellista isomeriaa kutsutaan myös diastereomeriaksi, jossa syn tarkoittaa ”samalla puolella” (cis) ja anti ”eri puolella” (trans). Eri diastereomeerit reagoivat monessa tapauksessa eri tavalla, erityisesti jos isomeria on renkaassa. Atomien ja sidosten väliset kulmat vaikuttavat suoraan siihen, miten sidosten orbitaalit sijaitsevat avaruudessa ja siten myös miten ne reagoivat. Esimerkiksi eliminaatioreaktioissa, joissa muodostuu kaksoissidos, poistuvien atomien on oltava samassa linjassa. Tämä onnistuu, jos ne ovat anti-muodossa eli vastakkaisilla puolilla, muttei silloin, jos ne ovat syn-muodossa eli samalla puolella. Sama pätee myös epoksidien muodostumiseen kloorialkoholeista, joka on SN2-reaktio: trans-2-klorosykloheksanoli muodostaa epoksidin, cis-2-klorosykloheksanoli ei. Jotta epoksidi muodostuisi, alkoholin hapen on päästävä C–Cl-sidoksen taakse, mikä ei onnistu cis-muodolta missään konformaatiossa.
| trans-1,2-dikloorisykloheksaani | cis-1,2-dikloorisykloheksaani |
Lähteet
muokkaa- ↑ a b c Cis, trans IUPAC GoldBook. IUPAC. Viitattu 12.7.2014. (englanniksi)