Idarubisiini
| |

| |
Idarubisiini
| |
| Systemaattinen (IUPAC) nimi | |
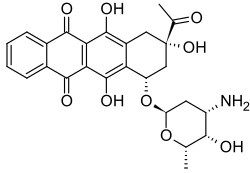
| (7S,9S)-9-asetyyli-7-[(2R,4S,5S,6S)-4-amino-5-hydroksi-6-metyylioksan-2-yyli]oksi-6,9,11-trihydroksi-8,10-dihydro-7H-tetraseeni-5,12-dioni | |
| Tunnisteet | |
| CAS-numero | |
| ATC-koodi | L01 |
| PubChem CID | |
| DrugBank | |
| Kemialliset tiedot | |
| Kaava | C26H27NO9 |
| Moolimassa | 497,486 |
| SMILES | Etsi tietokannasta: , |
| Fysikaaliset tiedot | |
| Sulamispiste | 183–185 °C (hydrokloridisuola)[1] |
| Farmakokineettiset tiedot | |
| Hyötyosuus | 40 %[2] |
| Proteiinisitoutuminen | 97 %[3] |
| Metabolia | Hepaattinen |
| Puoliintumisaika | 16 h (idarubisiini), 46-54 h (idarubisinoli)[2] |
| Ekskreetio | Virtsan mukana |
| Terapeuttiset näkökohdat | |
| Raskauskategoria |
? |
| Reseptiluokitus |
|
| Antotapa | Oraalinen, intravenoosi |
Idarubisiini (C26H27NO9) on antrasykliineihin kuuluva orgaaninen yhdiste. Yhdistettä voidaan käyttää lääketieteessä useiden syöpien hoidossa.
Ominaisuudet ja käyttö
muokkaaHuoneenlämpötilassa idarubisiini on oranssia kiteistä ainetta. Yhdiste on optisesti aktiivinen ja sen ominaiskiertokyky metanoliliuoksessa on +205.[1] Idarubisiinin rakenne koostuu daunosamiinisokerista ja aglykonista nimeltä 4-demetoksidaunorubisinoni[4].
Idarubisiini interkalatoituu muiden antrasykliinien tavoin DNA:n kaksoiskierteen väliin. Yhdiste estää topoisomeraasi I:n toimintaa, minkä seurauksena syöpäsolujen DNA:n vaurioiden korjaaminen, RNA:n synteesi ja proteiinisynteesi estyvät. Elimistössä siitä muodostuu maksassa idarubisinolia, joka on myös lääkeaineena aktiivinen. Ainetta voidaan käyttää yhdessä sytarabiinin ja tioguaniinin kanssa. Idarubisiinia voidaan käyttää muun muassa leukemian, lymfoomien ja pitkälle edenneen rintasyövän hoidossa. Monista muista poiketen idarubisiini voidaan annostella myös tablettina laskimoon annettavan infuusion lisäksi.[2][5][6]
Haittavaikutukset
muokkaaTyypillisiä idarubisiinin haittavaikutuksia ovat huonovointisuus, maksa-arvojen muutokset, iho-oireet ja luuydinsuppressio. Verrattuna daunorubisiiniin ja doksorubisiiniin idamysiinin sydäntoksisuus on niitä selvästi alhaisempi.[6][7][8]
Synteesi
muokkaaIdarubisiini on daunorubisiinin johdannainen ja sitä voidaan valmistaa siitä puolisynteettisesti. Suuressa mittakaavassa kokonaissynteesi on kuitenkin tehokkaampi tapa. (–)-1,4-dimetoksi-6-hydroksi-6-asetyylitetraliini reagoi ftaalianhydridin kanssa. Muodostuva välituotteen karbonyyliryhmä suojataan ketaalina ja reaktio bromin sekä atsobisisobutyronitriilin kanssa ja hydrolyysi muodostavat idarubisiinin aglykoniosan. Daunosamiini voidaan liittää aglykoniin joko N,O-bis(trifluoriasetyyli)daunosaminyylikloridin avulla hopeatriflaatin katalysoimana tai bioteknisesti Streptomyces peucetius-bakteerin avulla.[5]
Lähteet
muokkaa- ↑ a b Susan Budavari (päätoim.): Merck Index, s. 840. 12th Edition. Merck & Co., 1996. ISBN 0911910-12-3. (englanniksi)
- ↑ a b c Erkki Elonen: 61. Kasvainten kemoterapia Farmakologia ja toksikologia. Medicina. Viitattu 29.7.2016.
- ↑ Idarubicin DrugBank. Viitattu 29.7.2016. (englanniksi)
- ↑ Michael Allwood,Andrew Stanley,Patricia Wright: The Cytotoxics Handbook, s. 361. Radcliffe Publishing, 2002. ISBN 9781857755046. Kirja Googlen teoshaussa (viitattu 29.7.2016). (englanniksi)
- ↑ a b Axel Kleemann: Antineoplastic Agents, 1. Nonhormonal, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2010. Viitattu 29.7.2016
- ↑ a b Michael Clinton Perry: The Chemotherapy Source Book, s. 602. Lippincott Williams & Wilkins, 2008. ISBN 978-0781773287. Kirja Googlen teoshaussa (viitattu 29.7.2016). (englanniksi)
- ↑ Terrence W. Doyle & Dolatrai M. Vyas: Chemotherapeutics, Anticancer, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2000. Viitattu 29.7.2016
- ↑ Michael S. Ewer,Edward T. H. Yeh: Cancer and the Heart, s. 38. PMPH-USA, 2013. ISBN 9781607950400. Kirja Googlen teoshaussa (viitattu 29.7.2015). (englanniksi)