Hemoglobiini
Hemoglobiini eli verenpuna (lyh. Hb)[1] (C2932H4724N828S8Fe4O848) muodostaa kolmasosan punasolusta. Se on rautapitoinen happea sitova[2] proteiini. Se kuljettaa punasolujen mukana pääosin happea, mutta jonkin verran myös hiilidioksidia. Hemoglobiinipitoisuuden määritys verinäytteestä kuuluu perusterveydenhuollossa useimmin tehtäviin verikokeisiin, sisältyen osakokeena perusverenkuvaan (PVK). Suomessa pitoisuus ilmoitetaan yksikössä grammaa/litra. Jos hemoglobiiniarvo on alle normaalin, kutsutaan tilaa anemiaksi. Suomessa vuonna 2003 käyttöön otetut kansalliset aikuisten (16 vuotta täyttäneet) viitearvot ovat miehillä 134–167 g/l ja naisilla 117–155 g/l.[3][4] Hemoglobiinin muoto muuttuu sen sitoessa happimolekyylejä. Tällöin hemoglobiinia nimitetään oksihemoglobiiniksi. Kun happea ei ole sitoutuneena hemoglobiiniin, sitä kutsutaan deoksihemoglobiiniksi. Deoksihemoglobiinin proteiiniosat sitovat hiilidioksidia.
Seuraavassa taulukossa on esitetty eri eläinlajien keskimääräisiä hemoglobiiniarvoja.[5]
| Hemoglobiini (g/l) | |
| Ihminen | 150 (mies) |
| 130 (nainen) | |
| Nauta | 110 |
| Sika | 127 |
| Hevonen | 145 (lämminverinen) |
| 110 (kylmäverinen) | |
| Siipikarja | 90 |
| Koira | 150 |
| Kissa | 115 |
| Lammas | 118 |
| Vuohi | 100 |
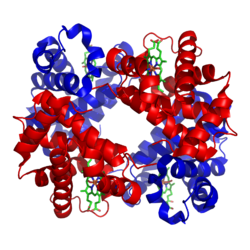
Hemoglobiinin rakenne
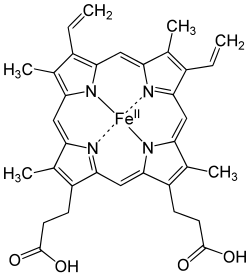
muokkaaHemoglobiini koostuu kahdesta α-globiini- ja kahdesta β-globiini-alayksiköstä sekä neljästä hemiyhdisteestä. Hemi on porfyriinirengas, jonka keskellä on rauta(II)-ioni (Fe2+). Kukin hemi voi sitoa yhden molekyylin happea reversiibelisti eli yhdessä hemoglobiinimolekyylissä voidaan kuljettaa neljä happimolekyyliä.
Hemiin liittyneiden proteiinien rakenne vaihtelee eläinlajeittain sekä joillakin lajeilla iän mukaan. Kaikilla nisäkkäillä on alkiokaudella erilainen hemoglobiini kuin aikuisella yksilöllä, joissa hemiin liittyneiden proteiinien rakenne on erilainen. Ihmisellä, märehtijöillä, sialla ja kanilla on sikiökaudella vielä kolmas erilainen hemoglobiini. Alkiokauden hemoglobiinista käytetään lyhennettä Hb E, sikiökauden hemoglobiinista lyhennettä Hb F ja aikuiskauden hemoglobiinista lyhennettä Hb A. Alkiokauden hemoglobiinia esiintyy vain hyvin varhaisessa sikiövaiheessa. Sikiövaiheen hemoglobiini korvautuu syntymän jälkeen muutamassa viikossa aikuisiän hemoglobiinilla. Sikiövaiheen hemoglobiini sitoo happimolekyylejä mieluummin kuin aikuisiän hemoglobiini, kun taas aikuisiän hemoglobiini luovuttaa happimolekyylinsä mieluummin. Sian aikuisiän ja sikiövaiheen hemoglobiineilla ei ole eroa happiaffiniteetissa.[5]
Ihmisen tutkituin hemoglobiinimolekyyli on hemoglobiini A.
Hemoglobiinin muodostus ja hajoaminen
muokkaaHemoglobiini muodostuu punasolujen muodostusvaiheessa luuytimessä, ei enää verenkierrossa kypsissä punasoluissa. Punasolujen hajoamisessa vapautuva hemoglobiinikin hajoaa ja sen hajoamistuotteena syntyvät aminohapot ja rauta-ioni hyödynnetään mm. uuden hemoglobiinin tuotannossa. Protoporfyriiniosa muutetaan bilirubiiniksi, joka kulkee verenkierrossa albumiiniin sitoutuneena maksaan. Maksa konjugoi bilirubiinin glukuronihappoon ja syntyvä yhdiste eritetään elimistöstä joko virtsan tai ulosteen mukana. Hajoaminen tapahtuu pääasiassa pernassa.
Katso myös
muokkaaLähteet
muokkaa- ↑ Lyhenneluettelo 07.01.2013. Kotimaisten kielten keskus. Arkistoitu 12.10.2013. Viitattu 23.2.2013.
- ↑ Turunen, Seppo: Biologia: Ihminen, s. 178. (5.–7. painos) WSOY, 2007. ISBN 978-951-0-29701-8
- ↑ Hiltunen, Holmberg, Jyväsjärvi, Kaikkonen, Lindblom-Ylänne, Nienstedt, Wähälä: Galenos - Johdanto lääketieteen opintoihin, s. 65. Helsinki: WSOYpro, 2010. ISBN 978-951-0-33085-2
- ↑ B-PVK+TKD viitearvot, HUSLAB tutkimusohjekirja [1]
- ↑ a b Sjaastad, Øystein V.: Physiology of domestic animals, s. 285. Oslo: Scandinavian Veterinary Press, 2003. ISBN 8291743118 OCLC:53046736 Teoksen verkkoversio.