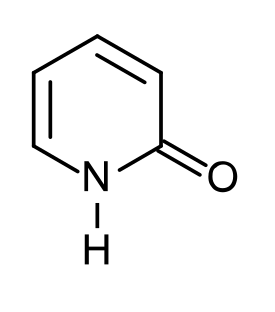
2-pyridoni
2-pyridoni (C5H5NO) on heterosyklinen yhdiste. Sitä käytetään muun muassa orgaanisessa synteesissä ja katalyyttinä.
| 2-pyridoni | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| IUPAC-nimi | 1H-pyridin-2-oni |
| CAS-numero | |
| PubChem CID | |
| SMILES | C1=CC(=O)NC=C1 [1] |
| Ominaisuudet | |
| Molekyylikaava | C5H5NO |
| Moolimassa | 95,10 g/mol |
| Sulamispiste | 107 °C[2] |
| Kiehumispiste | 294 °C[2] |
| Tiheys | 1,39 g/cm3 |
| Liukoisuus veteen | Liukenee hyvin veteen |
Tautomeria
muokkaa2-pyridonilla esiintyy kaksi tautomerista muotoa: 2-pyridoni ja 2-hydroksipyridiini. Tämä tautomerian muoto on laktaami-laktiimi-tautomeria. Näistä laktiimimuotoinen 2-hydroksipyridiini on vallitseva ainoastaan kaasufaasissa. Kiinteässä faasissa 2-pyridoni on selkeästi vallitseva, mutta liuoksessa tautomeeri riippuu liuottimesta. Polaarisessa liuottimessa laktaamimuotoinen 2-pyridoni on vallitseva tautomeeri, kun poolittomat liuottimet suosivat laktiimimuotoista 2-hydroksipyridiiniä.[3][4]
Valmistus, reaktiot ja käyttö
muokkaa2-pyridonia voidaan valmistaa pyridiini-N-oksidista. Yhdiste muuntuu 2-pyridoniksi, kun sitä käsitellään etikkahappoanhydridillä.[2]
2-pyridoni reagoi helposti elektrofiilien kanssa elektrofiilisella aromaattisella substituutiolla. Tässä suhteessa se eroaa esimerkiksi pyridiinistä. Se reagoi hyvin helposti myös nukleofiilien kanssa nukleofiilisella aromaattisella substituutiolla. Esimerkiksi fosforyylikloridin kanssa muodostuu 2-klooripyridiiniä. Reaktion ensimmäisessä vaiheessa muodostuu fosfaattiesteri 2-pyridonin happiatomin ja fosforiatomin välille. Fosfaattiryhmä on hyvä lähtevä ryhmä, jota seuraa kloridi-ionin hyökkäys renkaaseen.[2][5][6][7]
2-pyridonia voidaan käyttää syntetisoitaessa lääkeaineita, kuten amfenidonia.[2] Sitä voidaan käyttää myös katalyyttinä eräissä reaktioissa, kuten estereiden ammonolyysissä ja sokerimolekyylien epimerisaatiossa. Näissä se toimii protoninsiirtokatalyyttinä.[6]
Lähteet
muokkaa- ↑ 2-hydroxypyridine – Substance summary NCBI. Viitattu 19. lokakuuta 2012.
- ↑ a b c d e Eric F. V. Scriven & Ramiah Murugan: Pyridine and Pyridine Derivatives, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2005 Teoksen verkkoversio Viitattu 19.10.2012
- ↑ H.W. Yang & B.M. Craven: Charge Density Study of 2-Pyridone. Acta Crystallographica B, 1998, 54. vsk, nro 6, s. 912-920. (englanniksi)
- ↑ Eric V. Anslyn, Dennis A. Dougherty: Modern Physical Organic Chemistry, s. 155. University Science Books, 2006. ISBN 978-1-891389-31-3 Kirja Googlen teoshaussa (viitattu 19.10.2012). (englanniksi)
- ↑ Catherine E. Housecroft, Edwin C. Constable: Chemistry: An Introduction to Organic, Inorganic and Physical Chemistry, s. 1274. Pearson Education, 2010. ISBN 9780273733089 Kirja Googlen teoshaussa (viitattu 19.10.2012). (englanniksi)
- ↑ a b Francis A. Carey & Richard J. Sundberg: Advanced Organic Chemistry A: Structure and Mechanisms, s. 674. Springer, 2007. ISBN 978-0-387-44897-8 (englanniksi)
- ↑ Jonathan Clayden, Nick Greeves, Stuart Warren, Peter Wothers: Organic Chemistry, s. 1152. Oxford University Press, 2008. ISBN 978-0-19-850346-0 (englanniksi)