Vapaa elektronipari
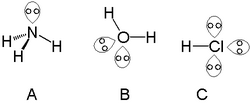
Vapaa elektronipari eli sitomaton elektronipari on yhdisteissä yhdelle atomille valenssikuorelle lokalisoituneita kemiallisen sidoksen muodostumiseen osallistumattomia elektronipareja. Lewis-rakenteissa vapaat elektroniparit piirretään kahtena pisteenä sille atomille, jolle ne kuuluvat.[1] Vaikka vapaat elektroniparit eivät osallistukaan kemiallisen sidoksen muodostamiseen yhdisteessä, on niillä vaikutusta yhdisteen rakenteeseen ja ominaisuuksiin.
Happo- ja emäsominaisuudet
muokkaaNukleofiilisillä neutraaleilla ja negatiivisen varauksen omaavilla anioneilla on tyypillisesti ainakin yksi vapaa elektronipari. Tällaisia ovat esimerkiksi amiinit, vesi, alkoholit, alkoksidi- ja syanidi-ionit. Näissä yhdisteissä vapaa elektronipari on HOMO:lla (korkein miehitetty molekyyliorbitaali) ja yhdisteet reagoivat luovuttamalla elektroniparin elektrofiilin LUMO:lle (alin miehittämätön molekyyliorbitaali). Monet vapaan elektroniparin omaavat yhdisteet ovat siis Lewis-emäksiä.[2][3]
Vapaan elektroniparin vaikutus yhdisteen rakenteeseen
muokkaaVSEPR-teorian mukaan yhdisteen sidoskulmiin vaikuttaa sekä sitovien että vapaiden elektroniparien aiheuttamat repulsiovoimat. Repulsiovoimat ovat suurimmillaan kahden vapaan elektroniparin välillä. VSEPR-teorian mukaan vapaat elektroniparit siis tarvitsevat enemmän tilaa ympärillään kuin sitovat elektroniparit, mikä johtaa siihen, että yhdisteessä sidoskulmat ovat pienempiä kuin ne olisivat ilman vapaita elektronipareja. Esimerkiksi VSEPR-teorian mukaan muodoltaan tetraedrisen vesimolekyylin sidoskulma ilman vapaita elektronipareja olisi tetraedrikulmaan perustuen ja 109 °, mutta kahden hapen vapaan elektroniparin vuoksi molekyyli on vääntynyt ja sidoskulma on 104,5 °.[4][5][6]
Jos vapaa elektronipari vaikuttaa yhdisteen rakenteeseen kutsutaan sitä stereokemiallisesti aktiiviseksi. Eräillä raskaampien alkuaineiden yhdisteillä on vapaita elektronipareja, jotka eivät vaikuta rakenteeseen VSEPR-mallin ennustamilla tavoilla ja näitä kutsutaan stereokemiallisesti inaktiivisiksi vapaiksi elektronipareiksi.[7]
Vapaan elektroniparin vaikutus dipolimomenttiin
muokkaaVapaa elektronipari voi joko vahvistaa tai heikentää molekyylin dipolimomenttia. Ammoniakissa vety on elektropositiivisempi kuin typpi, jolloin typellä on negatiivinen osittaisvaraus ja vedyllä positiivinen. Tästä aiheutuva dipolimomenttivektori on samansuuntainen kuin typen vapaan elektroniparin aiheuttama ja ne vahvistavat toisiaan ja ammoniakin dipolimomentti on 1,47 D. Typpitrifluoridissa typpi on fluoria elektropositiivisempi ja saa positiivisen osittaisvarauksen. Nyt typen ja fluorin välisen sidoksen aiheuttava momenttivektori on vastakkaissuuntainen typen vapaan elektroniparin aiheuttamaan vektoriin nähden ja dipolimomentti on vain 0,24 D.[4]
Lähteet
muokkaa- ↑ Lone (electron) pair IUPAC GoldBook. IUPAC. Viitattu 16.7.2014. (englanniksi)
- ↑ Tapio A. Nevala: Hapot ja emäkset Kuopion yliopisto. Viitattu 16.7.2014.
- ↑ Jonathan Clayden, Nick Greeves, Stuart Warren: Organic Chemistry, s. 112. Oxford University Press, 2012. ISBN 978-0-19-927029-3. (englanniksi)
- ↑ a b Catherine E. Housecroft, A. G. Sharpe: Inorganic chemistry, s. 40, 43–48. Pearson Education, 2007. ISBN 9780131755536. (englanniksi)
- ↑ Steven S. Zumdahl, Susan A. Zumdahl: Chemistry, s. 382. 8. painos. Brooks Cole. ISBN 978-0-495-82992-8. (englanniksi)
- ↑ Chemical Bonding Encyclopædia Britannica. Viitattu 16.7.2014. (englanniksi)
- ↑ Catherine E. Housecroft, Edwin C. Constable: Chemistry: An Introduction to Organic, Inorganic and Physical Chemistry, s. 232. Pearson Education, 2010. ISBN 9780273733089. Kirja Googlen teoshaussa (viitattu 16.08.2012). (englanniksi)