Dimetoksietaani
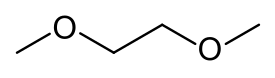
Dimetoksietaani eli etyleeniglykolidimetyylieetteri (C4H10O2) on eetteri, jota käytetään erityisesti liuottimena. Aine muodostaa myös kelaatteja kationien kanssa.
| Dimetoksietaani | |
|---|---|
 |
|
| Tunnisteet | |
| IUPAC-nimi | 1,2-dimetoksietaani |
| CAS-numero | |
| PubChem CID | |
| SMILES | COCCOC[1] |
| Ominaisuudet | |
| Molekyylikaava | C4H10O2 |
| Moolimassa | 90,12 g/mol |
| Sulamispiste | −58 °C[2] |
| Kiehumispiste | 85 °C[2] |
| Tiheys | 0,86 g/cm3[3] |
| Liukoisuus veteen | Sekoittuu[3] |
Ominaisuudet
muokkaaHuoneenlämmössä dimetoksietaani on neste, jolla on sille tyypillinen haju.[3] Aine sekoittuu veteen muodostaen atseotrooppisen seoksen. Dimetoksietaani sekoittuu myös moniin muihinkin liuottimiin kuten tetrahydrofuraaniin, dietyylieetteriin ja bentseeniin. Alifaattisiin hiilivetyihin se sen sijaan liuokenee[4]. Yhdiste reagoi voimakkaasti hapettimien kanssa ja voi muodostaa orgaanisia peroksideja.[3]
Synteesi
muokkaaDimetoksietaania voidaan valmistaa usealla eri tavalla. Williamsonin synteesissä valmistetaan 2-metoksietanolin natriumsuola natriummetoksietoksidi, jota käsitellään kloorimetaanilla.[4]
- 2 CH3OCH2CH2OH + 2 Na → 2 CH3OCH2CH2ONa + H2
- CH3OCH2CH2ONa + CH3Cl → CH3OCH2CH2OCH3 + NaCl
Myös 2-metoksietanolin metylointi dimetyylisulfaatilla ja etyleenioksidin hajotus dimetyylieetterin avulla booritrifluoridikaasun toimiessa katalyyttinä tuottavat dimetoksietaania. Jälkimmäinen reaktio ei ole kovin tehokas ja tuottaa myös useita muita tuotteita.[4]
Dimetoksietaania voidaan valmistaa myös suoralla eetteröintireaktiolla glykolista ja metanolista.[4]
- HOCH2CH2OH +2 CH3OH → CH3OCH2CH2OCH3
Käyttö
muokkaaDimetoksietaani on aproottinen liuotin. Sen kiehumispiste on korkeampi kuin esimerkiksi tetrahydrofuraanin tai dietyylieetterin, joten sitä käytetään liuottimena reaktioissa, jotka tapahtuvat hieman korkeammissa lämpötiloissa. Erityisesti ainetta käytetään liuottimena orgaanisten metalliyhdisteiden reaktioissa ja nukleofiilisissä reaktioissa.[4] Aine kykenee liuottamaan myös elektroneja.[5]
Turvallisuus
muokkaaAine on palavaa ja voi muodostaa räjähtäviä seoksia hapettimien kanssa. Dimetoksietaanin nieleminen aiheuttaa pahoinvointia. Aine saattaa aiheuttaa haittaa ihmisen kehitykselle.[3]
Lähteet
muokkaa- ↑ 1,2-dimethoxyethane – Substance summary NCBI. Viitattu 1. huhtikuuta 2009.
- ↑ a b Physical properties: 1,2-Dimethoxyethane NLM Viitattu 1.4.2009
- ↑ a b c d e Dimetoksietaanin kansainvälinen kemikaalikortti Viitattu 1.4.2009
- ↑ a b c d e 1,2-dimethoxyethane Chemindustry.ru. Viitattu 1.4.2009. (englanniksi)
- ↑ Henning Lund, Ole Hammerich: Organic electrochemistry, s. 270. CRC Press, 2002. ISBN 9780824704308 Kirja Googlen teoshaussa (viitattu 1.4.2009). (englanniksi)
Aiheesta muualla
muokkaa- Dimetoksietaanin käyttöturvallisuustiedote, Sigma Aldrich, viitattu 18.1.2015.


