CCSVI
| Tämän artikkelin tai sen osan kieliasua on pyydetty parannettavaksi. Voit auttaa Wikipediaa parantamalla artikkelin kieliasua. |
Krooninen keskushermoston laskimoiden vajaatoiminta (CCSVI, Chronic cerebrospinal venous insufficiency) on italialaisen laskimoasiantuntija Paolo Zambonin vuonna 2009 nimeämä tutkimuslöydös[1]. CCSVI tarkoittaa keskushermostota verta poistavien kaulan jugularislaskimoiden tai azygoslaskimon rakennemuutoksia, jotka heikentävät verenvirtausta laskimossa ja keskushermostossa. Zambonin tutkimuslöydös on liitetty MS-tautiin ja tehdyissä meta-tutkimuksissa CCSVI on todettu enemmän MS-diagnosoiduilla kuin terveillä verrokeilla[2][3][4]. Tiedekentällä CCSVI on erittäin kiistanalainen ja erityisesti näkemyserot ovat korostuneet neurologisen tieteenhaaran ja CCSVI-tutkijoiden (verisuoni, radiologiaselvennä) kesken[5]. Yksi suurimmista ongelmista on ollut CCSVI:n diagnosointi ja eri tutkijat ovatkin saaneet hyvin erilaisia tutkimustuloksia. On esitetty, että erilaiset tutkimustulokset johtuisivat erilaisista tutkimusmetodeista ja uusi mittausmetodi vaatisi lisäkoulutustaselvennä[6]. CCSVI:n yleisin hoitomuoto on laskimon pallolaajennus.

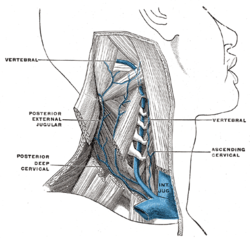

Patofysiologia muokkaa
Kansainvälisen laskimosairauksia tutkivan järjestön (International Union of Phlebology) mukaan Chronic cerebrospinal venous insufficiency (CCSVI) on laskimosairaus, minkä synnyn taustalla on jo sikiövaiheessa tapahtunut kehityshäiriö.[7][8] CCSVI on syndrooma, jossa kaulan jugulaarilaskimoon ja/tai azygoslaskimoon on muodostunut erilaisia virtausesteitä. Nämä poikkeavuudet ovat pääasiassa intraluminaalisia eli laskimon sisäisiä epämuodostumia (esim. web, annulus, membrane) ja erityisesti laskimoläppien poikkeavuudet on liitetty CCSVI:n.[9][10][1] Amerikkalaistutkijat (Diaconu et al, 2011) tekivät kuolemanjälkeisen tutkimuksen, jossa MS-tautia sairastaneiden sekä kontrollivainajien laskimorakenteita analysoitiin. Tutkimuksessa todettiin laskimonsisäisiä poikkeavuuksia MS-ryhmässä enemmän kuin kontrolliryhmässä (5/7 vs 1/5).[11] Eräässä toisessa kuolemanjälkeisessä tutkimuksessa tutkijat löysivät CCSVI:tä tukevia poikkeavuuksia MS-diagnosoitujen vainajien kaulalaskimoista.[12]
Laskimonsisäisten virtausesteiden lisäksi tutkimuksissa on kartoitettu muitakin tekijöitä, jotka mahdollisesti heikentävät verenvirtausta kaulanlaskimoissa. Radak et al (2014) tutkivat varjoainekuvauksella 51 CCSVI diagnosoidun kaulan aluetta ja heistä 51 %:lla löytyi laskimoa painava kudos (mm. niskanikaman poikkihaarake).[13] Zamboni et al havaitsivat eräällä tutkittavalla kaulan alueen lihaksen (omohyoid) painavan kaulanlaskimoa. Lihaksen kirurginen operointi korjasi potilaan verenvirtauksen ja paransi tutkittavan neurologista tilaa.[14]
CCSVI-diagnosoitujen jugulaarilaskimoiden rakenteita on kartoitettu kudosnäytteitä tutkimalla. Vuonna 2013 julkaistussa tutkimuksessa Coen et al vertailivat mikroskoopilla viiden MS/CCSVI-diagnosoidun sekä kahdeksan verrokin jugulaarilaskimoista saatuja kudosnäytteitä. Tutkimuksessa todettiin, että MS-ryhmässä jugulaarilaskimoiden seinämissä oli tapahtunut paksuuntumista ja kollageeni III pitoisuuksien kasvua.[15] Heinäkuussa 2014 julkaistussa tutkimuksessa oli vertailtu seitsemän CCSVI-diagnosoidun ja kontrollien jugulaarislaskimoiden kudosnäytteitä mikroskoopilla ja tutkimuksessa todettiin, että CCSVI-ryhmässä laskimoiden seinämien endoteelisolukossa oli tapahtunut muutoksia.[16] Lorella Pascolo et al (2014) vertilivat myös MS-diagnosoitujen ja kontrollien jugulaarilaskimoita sekä mikroskoopilla että röntgenfluoresenssi (XRF) -analyysimentelmällä. Heidän tutkimuksensa osoitti, että MS-diagnosoitujen jugulaarilaskimoissa ulkokerroksen (tunica adventitia) kalkkipitoisuudet olivat kontrolleja korkeammat.[17]. Laskimorakenteen muutoksista kertoo myös Farina et al (2013) tekemä tutkimus, jossa oli mukana 313 MS-diagnosoitua ja 298 tervettä kontrollia. Tutkijat mittasivat doppler-signaalin värikoodauslaitteistolla ("väridoppler") jugulaarilaskimon läpimitan kasvua, kun makuuasennosa olevan tutkittavan päätä käännettiin 90 astetta sivulle. Vain MS-diagnosoiduilla jugulaarilaskimon läpimitassa tapahtui merkittävä kasvua, minkä tutkijat päättelivät johtuvan laskimokudoksen toiminnan häiriöstä (miopragia).[18]
Useissa CCSVI tutkimuksissa on pyritty selvittämään miten laskimopoikkeavuudet vaikuttavat verenvirtaukseen. Yksi merkki kaulanlaskimoiden virtausesteistä on verenvirtauksen vaihtoehtoisten reittien (kollateraali suonisto) aktivoituminen.[1][19][20][21] Kaulan laskimon virtauksia on kartoittanut muun muassa Veroux et al (2013), joiden tutkimuksessa vertailtiin 313 MS-potilaan ja 12 kontrollin jugulaarilaskimon virtausta. Tutkimuksessa käytetty menetelmä oli katetrivenografia, jonka tyhjentymisaikaa mitattiin tutkittavien laskimoista. Tutkijat pitivät normaalina tyhjentymisaikana alle neljän sekunnin aikaa. MS-potilaista 89 %:lla veren tyhjentymisaika oli hidastunut joko kohtalaisesti (4–6 sek) tai vakavasti (yli 6 sek).[22]
Napolin yliopiston tutkijat (Mancini et al, 2014) tutkivat MS-tautipotilaiden (n=58selvennä), CIS-potilaiden (n=7selvennä) ja kontrollien (n=13) kaulan alueen verenvirtausta mittaamalla varjoaineen puhdistumista (washout) tutkittavien jugulaarilaskimoista. Tutkimuksen päätulos oli se, että MS-tautipotilaiden jugulaarilaskimon ulosvirtaus on heikentynyt noin 30 prosentilla. Tutkijat havaitsivat myös tilastollisesti merkittävän korrelaation laskimon ulosvirtauksen ja invaliditeetin suhteen.[21] Yhdysvaltalainen tutkijaryhmä Mehta et al mittasi myös varjoaineen ulosvirtausta 50 MS-tautipotilaan ja 12 kontrollihenkilön jugulaarilaskimoista. Heidän tutkimuksessaan MS-tautipotilaiden hidastunut verenvirtaus parantui pallolaajennuksen myötä samalle tasolle kuin kontrolliryhmässä. Tutkijoiden mukaan toimenpide onnistui teknisesti 78 prosentilla tutkimukseen osallistuneista MS-tautipotilaista.[23]
MS-taudissa keskushermoston verenvirtausta on tutkittu jo ennen CCSVI löytämistä, ja tehdyissä tutkimuksissa on osoitettu, että MS-tautipotilaiden aivoissa verenvirtaus on heikentynyt.[24][25][26][27] Varmaa syytä MS-taudissa ilmenevälle hypoperfuusiolle (vähentynyt / riittämätön veren läpivirtaus aivoissa) ei vielä tiedetä, mutta CCSVI:n osuutta on alustavasti selvitelty muutamissa tutkimuksissa. Buffalon yliopiston sekä Paolo Zambonin ryhmän pilottitutkimuksessa analysoitiin 16 MS-tautipotilaan sekä kahdeksan terveen verrokin laskimoiden hemodynaamista haitta-astetta (VHISS) sekä aivojen verenvirtausta (perfuusio). Sokkoutetusti toteutetussa ultraäänitutkimuksessa CCSVI todettiin ainoastaan MS-tautipotilailla. Tutkimuksen päätulos oli se, että laskimoiden hemodynaamisella haitta-asteella oli tilastollisesti merkittävä yhteys aivojen verenvirtauksen heikkenemiseen useimmilla aivojen alueilla.[28] Toisessa tutkimuksessa amerikkalaisryhmä edelleen analysoi CCSVI:n ja aivojen verenvirtauksen suhdetta 59 MS-tautipotilaan ja 33 verrokin ryhmistä. Tässä tutkimuksessa saatu tulos oli, että CCSVI:n tasopisteytys (VHISS score) heijastui aivojen verisuoniston näkyvyyteen magneettikuvissa (SWI venography).[29]
CCSVI-tutkimuksissa on selvitelty myös muitakin MS-tautiin liitettyjä patofysiologisia ilmiöitä. Useissa tutkimuksissa on todettu, että MS-taudissa aivojen eri alueille kertyy normaalia suurempia rautapitoisuuksia.[30][31][32][33][34][35][36] Raudan kertymistä MS-tautipotilaiden aivokudokseen on joissakin tutkimuksissa esitetty liittyvän CCSVI:n mekanismeihin.[37][38][39][40] Alustavia tutkimuksia on tehty myös laskimon operoinnin vaikutuksista selkäydinnesteen virtaukseen. Zivadinovin tutkimusryhmän mukaan 15 MS-tauti potilaan ryhmässä selkäydinnesteen virtaus parantui kaulalaskimon pallolaajennuksen myötä ja tutkijat arvelivat tämän johtuvan laskimovirtauksen parantumisesta.[41] Syksyllä 2014 julkaistussa tutkimuksessa D'Alessandro et al olivat tutkineet 33 MS/CCSVI diagnosoidun potilaan ja verrokin kolmannen aivokammion laajentumista. Heidän tuloksensa oli se, että 88 prosentilla MS-tautipotilaista kolmas aivokammio oli normaalia laajempi. Heidän mukaansa laajentuminen saattaa liittyä CCSVI:n myötä tapahtuvaan selkäydinnesteen kertymiseen aivoissa.[42]
CCSVI MS-tautipotilailla muokkaa
CCSVI:n esiintyvyyttä MS-tautipotilailla on tutkittu runsaasti vuodesta 2009 alkaen ja tutkimustulokset ovat vaihdelleet ääripäästä toiseen. Erilaisten tutkimustuloksien esiintyvyyttä on esitetty johtuvan erilaisista tutkimusmenetelmistä, tekniikoista, kriteereistä ja harjoittelusta.[43][44][6] Aivojen verisuonisairauksia tutkiva kansainvälinen järjestö (ISNVD) on laatinut ohjeistavan suosituksen eri kuvantamis- ja mittausmenetelmille CCSVI:n diagnosointiin, jotta menetelmät tulisivat yhdenmukaisemmiksi tutkijoiden keskuudessa. Järjestön 30 sivuinen ohjeistus julkaistiin heinäkuussa 2014 Journal of Vascular and Interventional Radiologyssa.[45]. CCSVI:tä on tutkittu pääasiassa erilaisilla ultraäänimittauksen-, magneettikuvantamisen- ja varjoainekuvantamisen menetelmillä.
Tarkkaa ja yksimielistä tietoa CCSVI:n esiintyvyydestä MS-taudissa ei tiedetä johtuen erilaisista tutkimustuloksista ja näkemyksistä. Alla on eritelty tutkimuksia, joissa yhteys CCSVI:n ja MS-taudin välillä on todettu.
Zambonin tutkimusryhmän vuonna 2008 julkaistussa tutkimuksessa analysoitiin 65 MS-tautipotilaan ja 235 kontrollin laskimopoikkeavuuksia värikaiku dopplermittauksella. Mittauksen tehneet henkilöt eivät tienneet mitattavan diagnoosia eli dopplertutkimukset toteutettiin sokkoutettuna. Vain MS-potilailla todettiin vähintään kaksi poikkeavaa CCSVI-kriteeriä ja verrokeilla ei vastaavaa esiintynyt. Tutkimukseen osallistuneista kaikkien MS-tautiryhmään (65) kuuluneille ja 48 kontrollille suoritettiin katetri venografia ja sen tulos vahvisti ultraääni tutkimuksen havaintoja. Lisäksi katetri venografia tuotti tarkempaa tietoa laskimopoikkeavuuksista.[1] Vuotta myöhemmin saman tutkimusryhmän julkaisu keskittyi värikaiku doppler mittauksen arviointiin MS-tautipotilaiden laskimopoikkeavuuksissa. Kaikkiaan109 MS-tautipotilaan ja 177 kontrollien aivojen sekä kaulan laskimoiden poikkeavuuksia mitattiin sokkoutetusti värikaiku doppler menetelmällä. Kontrolliryhmässä todettiin 861 normaalia ja 24 poikkeavaa parametriä. MS-tautipotilaiden ryhmässä normaaleja arvoja löytyi 288 ja epänormaaleja oli 257. Terveillä verrokeilla ei yhdelläkään todettu kahta epänormaalia arvoa samassa yksilössä.[46]
Rooman yliopiston Luciana Tromba et al tutkimuksessa analysoitiin myös sokkoutetusti 112 MS-tautipotilaan sekä 67 terveen verrokin laskimoita. Mittaukset teki yksi henkilö, jolla oli 30 vuoden kokemus ultraäänitutkimuksista. Tutkimuksen sokkoutus oli toteutettu niin, että tutkittava oli tuotu tutkimustuoliin ennen tutkijaa ja he eivät saaneet puhua keskenään. Ultraäänimittaukset tehnyt Luciana Tromba noudatti Zambonin ultraäänitutkimuksen menetelmää, vaikkakaan ei ollut saanut siihen erikseen koulutusta. Hän ei todennut CCSVI:tä kenelläkään terveellä verrokilla, sen sijaan kaksi CCSVI kriteeriä täyttyi 59,8 %:lla MS-tautipotilaista.[47]
CCSVI:n ultraäänitutkimisen koulutuksen ja harjoittelemisen puolesta kantaa ottanut, verisuonikirurgi Pietro Bavera kollegoineen julkaisivat oman tutkimuksensa, missä Zambonin dopplermetodilla tutkittiin kaikkiaan 823 MS-tautipotilasta sekä 60 verrokkia. MS-tautipotilailla CCSVI diagnosoitiin 90 %:lla ja terveillä kontrolleilla 5 %:lla. He tutkivat myös 127 laskimo-operoidun MS-tautipotilaan verenvirtausta dopplermittauksella ja toimenpiteen jälkeen tehty mittaus osoitti, että 69 %:lla (88/127) potilaista CCSVI kriteerit eivät enää täyttyneet. Parantunut veren hemodynamiikka assosioitui potilaiden oireiden helpottumisena.[44]
Kanada-Italia yhteistyönä tehtyyn tutkimukseen osallistui kuusi klinikkaa, jotka noudattivat myös Zambonin dopplermetodia. Kaikkinensa klinikat tutkivat yhteensä 710 MS-tautipotilasta. CCSVI kriteerit täyttyivät 86 %:lla tutkituista potilaista. Muita tutkimuksen huomioita olivat se, että ikä ja potilaan invaliditeettipisteytys (EDSS) olivat CCSVI diagnoosiin liittyviä tekijöitä.[48]
Laskimosairauksien asiantuntija Marian Simka tutki kollegoidensa kanssa 70 MS-tautipotilaan laskimopoikkeavuuksia ja heilläkin tutkimusmetodina Zambonin dopplermetodi. Heidän tutkimuksessaan 90 prosentilla MS-tautipotilaista todettiin CCSVI. Heidän yleisin löytämänsä jugulaarilaskimon poikkeavuus toimimaton laskimoläppä tai muut patologinen virtauseste (membranaceous or netlike septum).[49]
Samainen tutkijaryhmä (Simka et al) julkaisi ultraäänitutkimuksensa jälkeen varsin laajan kartoituksen, missä kaikkiaan 563 MS-tautipotilaan laskimot tutkittiin katetrivenografialla. Heidän tutkimuksessaan CCSVI todettiin 96 prosentilla tutkituista MS-tautipotilaista. Tutkijat itse pitivät tutkimuksensa vahvuutena sitä, että tutkimus toteutettiin menetelmällä, mitä pidetään alan kultaisena standardina.[50]
CCSVI:tä on tutkittu myös menetelmällä, mikä tunnetaan nimellä pletysmografia. Vuonna 2012 julkaistussa pilottitutukimuksessa 40 terveen kontrollin ja 44 MS-tautipotilaan kaulanalueen laskimovirtauksia tutkittiin kaulalle asettavalla mittalaitteella. Tutkimuksessa kukin tutkittava asetettiin tutkimustuoliin, mikä käännettiin vaakatasosta pysyasentoon ja tutkittavien kaulalle asetettu mittalaite keräsi tietoa verenvirtauksen muutoksista. Tutkimus oli sokkoutettu eli mittajaavat eivät tienneet kumpaan ryhmään tutkittava kuului. Tutkimuksessa todettiin, että terveiden kontrollien jugulaarilaskimoiden ulosvirtaus tapahtui huomattavasti nopeammin kuin MS-tautipotilaiden. Tutkijat pitivät pletysmografiaa hyvin potentiaalina CCSVI:n tutkimiseen, koska menetelmä on objektiivinen ja kykenee erottamaan CCSVI:lle tyypillistä poikkeavaa laskimovirtausta.[51] Tätä Zambonin kehittämää pletysmografia sovellusta hyödynnetään myös astronauttien laskimoverenvirtauksen tutkimuksessa ja Paolo Zamboni on avaruusjärjestö NASA:n ”Drain Brain” tutkimuksen päätutkija. Tutkimuksen tarkoitus on selvittää, että johtuvatko pitkään avaruudessa olleiden astronauttien päänsäryt ja neurologiset oireet laskimovirtauksen hidastumisesta.[52]
MS-taudin ja CCSVI:n välistä yhteyttä on selvitelty myös meta-tutkimuksilla. Vuonna 2011 kanadalaistutkijat (Laupacis et al) analysoivat aiempia tutkimuksia ja kelpuuttivat kahdeksan sellaista tutkimusta mukaan, joissa oli tutkittu CCSVI:tä sekä MS-tautia sairastavien että terveiden kontrollien ryhmissä. Heidän tulkinta oli se, että CCSVI liittyy MS-tautiin. Tosin he totesivat myös, että analysoiduissa tutkimuksissa saadut tulokset olivat poikkeuksellisen heterogeenisiä.[2] Toinenkin meta-tutkimus julkaistiin 2011 ja siinä tutkijat (Thapar et al) analysoivat tehtyjä ultraäänitutkimuksien tuloksia. Heidänkin tulkinta oli se, että CCSVI:tä esiintyy enemmän MS-tautia sairastavilla kuin verrokeilla. Tutkimuksen päätelmässä tutkijat totesivat, että meta-tutkimuksen tulos olisi luotettavampi mikäli analysoiduissa tutkimuksissa olisi käytetty samanlaista ultraäänitutkimuksen menetelmää.[3] Kolmas meta-tutkimus julkaistiin 2013 ja sen toteuttivat englantilaiset tutkijat (Zwischenberger et al). Meta-tutkimukseen sisällytettiin yhdeksän aikaisempaa tutkimusta, joista tehdyn analyysin mukaan CCSVI:llä ja MS-taudilla on yhteys, joskin aineiston perusteella eivät voineet vetää johtopäätöksiä kausaalisuuden suhteen.[4]
CCSVI:n ja MS-taudin välisen yhteyden kritiikki muokkaa
Roberta Lanzillo kollegoineen Tutkivat Napolissa CCSVI muutoksia MS-potilailla ja terveillä vapaaehtoisilla. Heidän aineistossaan MS-potilailla oli jonkin verran enemmän CCSVI muutoksia (80,8 %), kuin terveillä vapaaehtoisilla (47,4 %). CCSVI muutokset korreloivat kuitenkin parhaiten potilaiden ikään eikä MS-taudin vaikeusasteeseen.[53]
Torinolainen tutkimusryhmä selvitti CCSVI muutoksien (vähintään 2 laskimomuutosta) yleisyyttä terveillä, MS-potilailla sekä muita neurologisia sairauksia sairastavilla potilailla. Heidän tutkimuksessaan ei tullut tilastollisesti merkittävää eroa ryhmien välille. CCSVI muutosten yleisyys ryhmissä oli: MS-potilaat 17,5 %, terveet 7,3 % ja muita neurologisia sairauksia sairastavat 11,5 %. Heikko assosiaatio yksittäisen ultraäänilöydöksen ja MS-taudin välillä saatiin verrattuna terveisiin kontrolleihin.[54]
PLOS one lehdessä julkaistu kanadalainen tutkimuksen, jossa tutkittiin 100 MS-potilaan ja verrokin laskimoita ultraäänellä ja magneettitutkimuksella[55]. Yksi tutkimusta tehneistä radiologeista oli saanut koulutuksen klinikassa, jossa myös Zamboni työskentelee[56]. Yhdelläkään tutkimuksessa mukana olleista henkilöistä ei todettu CCSVI muutoksia.
Vastikäänmilloin? julkaistu italialainen tutkimus CCSVIstä ja MS taudista ei pystynyt vahvistamaan näiden kahden välistä yhteyttä. 68 MS-tauti potilasta ja 68 tervettä vapaaehtoista tutkittiin väri-kaiku Doppler menetelmällä. Kyseessä oli sokkoutettu tutkimus. Tarkoituksena oli selvittää onko CCSVIn ja MS-taudilla ylipäänsä yhteyttä ja korreloiko CCSVI MS-taudin vaikeuden kanssa. CCSVI muutoksia todettiin 21:llä potilaalla (30,9 %) ja 23:lla kontrolli (33,8 %). Lisäksi havaittiin, että kliinisesti CCSVI positiivisilla ja negatiivisilla MS-tautipotilailla ei ollut tilastollisesti merkittävää eroa taudin vaikeusasteesta.[57] Aiemmin julkaistu italialainen tutkimus ei myöskään pystynyt todentamaan CCSVI muutosten ja MS-taudin välistä yhteyttä.[58] Tässä tutkimuksessa oli mukana 40 MS-potilasta ja 34 tervettä henkilöä. CCSVI muutoksia todettiin 55 %:lla potilaista ja 35 %:lla kontrolliryhmäläisistä, mutta tulos ei ollut tilastollisesti merkitsevä (p=0.089). Tänä vuonna (2013) julkaistu amerikkalainen tutkimus selvitti samoin CCSVIn ja MS-taudin yhteyttä. Mukana oli 206 MS-tautia sairastavaa vapaaehtoista ja 70 ei MS-tautia sairastavaa kontrollihenkilöä. Ultraäänitutkimuksen tekijä oli sokkoutettu tutkittavan ryhmän suhteen. Tässäkään tutkimuksessa ei MS-tautia sairastavien ja sairastamattomien ryhmien välillä ollut eroa.[59] Eräässä tanskalaisessa tutkimuksessa CCSVIn ja MS-taudin välistä yhteyttä. Tässä tutkimuksessa mukana oli 24 MS-tautia sairastavaa potilasta ja 15 tervettä kontrollia. Tutkimuksessa käytettiin kallon ulkopuolista korkean resoluution väridoppler-ultraääntä, transkraniaalista väridoppleria, MRI ja faasikontrasti-MR menetelmiä kaulan ja kallonsisäisten laskimoiden tutkimiseksi. Ryhmien välillä ei ollut merkittäviä eroja. CCSVIksi luokiteltuja muutoksia oli MS-tautia sairastavien ryhmässä 1/24 ja terveiden ryhmässä 2/15. Yhdelläkään ei tutkimuksissa havaittu kuin korkeintaan yksi CCSVI muutos.[60]
Saksassa tehty tutkimus selvitti dopplerultraäänen ja magneettiresonanssivenografian avulla laskimopaluuta MS-tautipotilailla. Mukana oli 40 MS-tautia sairastavaa potilasta. Tutkimuksessa mitattiin sisäisen jugulaarilaskimon ja azygoslaskimon ahtaumaa, joka jaettiin kolmeen ryhmään 0–50 % ahtaumaan, 51–80 % ahtaumaan ja yli 80 % ahtaumaan. Vasta yli 80 % ahtauman todettiin vaikuttavan hemodynaamisesti merkittävästi. Ultaäänitutkimuksen perusteella vain 4 potilaalla todettiin poikkeamaa laskimopaluussa. Tutkimuksen pääasiallinen löydös oli, että verrattuna Zambonin alkuperäiseen tutkimukseen ultraäänellä todennettaviin CCSVI muutoksia oli saksalaisessa aineistossa huomattavasti vähemmän.[61] Toisen saksalaisen tutkimusryhmän tutkimuksessa selvitettiin 20 MS-potilaan ja 20 verrokin laskimopaluuta. Tutkimus oli nk. kolmoissokkoutettu, jossa tutkimuksen suorittaja, datan analysoija ja tilastotieteilijä eivät tienneet tutkimushenkilön ryhmästä. Kenelläkään tutkituista ei todettu retrograadista virtausta. Yhdelläkään MS-tautipotilaista ja vain yhdellä kontrolleista oli kaksi CCSVI muutosta. Tutkijoiden johtopäätöksen mukaan heidän datansa ei tue esitettyä CCSVI:n ja MS-taudin välistä yhteyttä.[62] Kolmannessa saksalaisessa tutkimuksessa selvitettiin MS-tautipotilaiden kallonsisäistä laskimopainetta verrattuna terveisiin verrokeihin. Mittarina käytettiin oftalmodynamometriä. Tutkimuksessa oli mukana 29 MS-tautia sairastavaa, 28 tervettä verrokkia ja 19 potilasta jolla kallonsisäinen paine oli kohonnut, mutta jolla ei ollut MS-tautia. Tuloksissa vain kolmannella ryhmistä oli kohonnut laskimopaine. Terveiden ja MS-potilaiden laskimopaineiden välillä ei todettu minkäänlaisia eroja.[63] Neljännessä Saksassa tehdyssä tutkimuksessa tulokset olivat edellisten kanssa samoja. CCSVI muutosten suhteen eroja terveiden ja MS-tautia sairastavien välillä todettu. Tässä tutkimuksessa 56 MS-tautia sairastavaa ja 20 tervettä verrokkia.[64] Kreikkalaisessa tutkimuksessa selvitettiin doppler-kaikututkimuksen keinoin laskimopaluun ongelmien ja MS-taudin yhteyttä. 42 MS-tautia sairastavaa potilasta ja 43 kontrollihenkilöä tutkittiin. Kriteereinä CCSVI:lle pidettiin laskimorefluksia kaulalaskimoista istualtaan ja seisaaltaan. Tutkimuksen yhteydessä tehtiin myös apnea testi ja valsalvan koe. Istualtaan refluksi todettiin yhdellä potilaalla (2 %) ja yhdellä kontrolliryhmään kuuluvalla. Valsalvan-manööverin yhteydessä refluksi oli todettavissa kolmella MS-potilaalla (7 %) ja neljällä kontrollilla (9 %). Näin ollen ryhmien välillä ei ollut eroja.[65] Lisäksi Tel Avivilainen tutkimus on päätynyt aikaisemmin mainittujen tutkijoiden kanssa samanlaisiin tuloksiin. Heidän tapaus-verrokki tutkimuksessaan oli mukana 27 MS-tautia sairastavaa ja 32 tervettä verrokkia. Tutkimuksessa ei ryhmien välillä ollut CCSVI muutosten suhteen eroja.[66]
Simka M et al tutkivat Puolassa CCSVI:n ja MS-taudin keston yhteyttä. Tässä tutkimuksessa he tekivät katetrivenografian ja vertasivat havaittuja CCSVI muutoksia MS-taudin kestoon. Tuloksissa oli heidän mukaansa heikko tilastollisesti merkityksetön korrelaatio MS-taudin keston ja CCSVI muutosten määrän kanssa. He päätyivät tutkimuksessa pitämään CCSVI muutoksia suurella todennäköisyydellä synnynnäisinä. Tutkimuksessa oli mukana 353 MS-tautipotilasta.[67]
Englantilaisessa tutkimuksessa selvitettiin onko MS-tauti potilaiden aivo-selkäydinnesteen ferritiinipitoisuus koholla. Hypoteesina tutkimuksessa oli, että heikentynyt laskimopaluu lisää rautakertymää aivoparenkyymissä ja näin ollen nostaisi intratekaalista raudankuljettajaproteiinin määrää. Ms-tautipotilaiden ferritiinipitoisuuksia verrattiin sideroosipotilaisiin, SAV-potilaisiin meningoenkefaliittipotilaisiin ja verrokeihin. MS-tautipotilaiden ferritiinipitoisuudet intratekaalisesti eivät olleet koholla.[68]
Harvardissa tutkittiin hiirillä laskimopaluun heikentymisen ja demyelinisaation välistä yhteyttä. Koehiirille (n=20) tehtiin molemmin puolin jugularis-laskimoihin ligaatio, joka heikensi laskimopaluuta mallintaen näin CCSVI-hypoteesiä. Kontrollihiirille tehtiin plasebo-operaatio (n=15) ja positiivisena kontrollina oli indusoitu encephalomyeliitti (n=8). Hiiriä seurattiin 6 kk ajan ja niille tehtiin CT-venografia. Lisäksi hiirille tehtiin histopatologinen arvio neuroinflammaation ja demyelinaation tutkimiseksi. Tutkimuksessa ei havaittu laskimoiden ahtauttavan toimenpiteen aiheuttavan minkäänlaista demyelinisaatiota tai neuroinflammaatiota.[69] Paolo Zamboni totesi vastineessaan, että tutkimus vahvisti CCSVI:n vaikuttavan aivojen verenvirtaukseen, sillä vain laskimoahtautetuilla hiirillä ilmeni MS-diagnosoiduillakin todettua hypoperfuusiota eli verenvirtauksen heikkenemistä aivoissa.[70]
Laskimoiden operointi ja hoitotulokset muokkaa
Useimmissa tehdyissä alustavissa kliinisissä tutkimuksissa laskimoiden pallolaajennuksella on todettu positiivisia vaikutuksia MS-tautipotilaiden oireisiin.[71][72][73][74][75][76][77][78][79][80][81][82] Tosin CCSVI laskimoahtaumissa käytettyjä toimenpiteitä tutkitaan edelleen, jotta tietyt ongelmakohdat saataisiin ratkaistua. Zamboni et al totesivat jo pilottitutkimuksessaan 2009, että noin puolella 47 %) operoiduista MS-tautipotilaista pallolaajennuksella avattu jugulaarilaskimo ahtautui uudelleen puolentoista vuoden tarkkailuaikana.[71] Myös Veroux et al tekemässä tutkimuksessa osoittautui, että pallolaajennus oli riittämätön toimenpide osalle operoiduista MS-tautipotilaista. He luokittelivat tutkimansa MS-diagnosoidut kolmeen ryhmään ja vakavasti hidastuneen virtauksen ryhmässä (juglaarilaskimon tyhjenemisaika yli 6 sekuntia) noin kolmasosalla pallolaajennuksella ei saavutettu virtauksen korjaantumista. Lievemmissä virtausongelmissa (tyhjenemisaika 4–6 sekuntia) pallolaajennus sen sijaan korjasi virtausnopeutta lyhyellä aikavälillä mitattaessa.[22]
Ensimmäisen kliinisen tutkimuksen CCSVI laskimoahtaumien hoitamisesta pallolaajennuksella toteutti Paolo Zambonin tutkimusryhmä, ja sen tulokset julkaistiin Journal of Vascular Surgery tiedejulkaisussa, loppuvuodesta 2009. Tässä pilottitutkimuksessa oli mukana 65 MS-tautipotilasta, kolmesta eri tautimuodosta (35 RR, 20 SP ja 10 PP). Tehdyn pallolaajennuksen vaikutuksia mitattiin 18 kk:n ajan. Tutkimuksessa todettiin, että pallolaajennus oli turvallinen hoitotoimenpide. Pallolaajennuksen myötä mitattiin laskimopaineen pieneneminen operoiduissa jugulaari- ja azygoslaskimoissa. MS-taudin liittyviä muutoksia todettiin erityisesti RR-muotoa sairastavassa ryhmässä; pahenemisvaiheiden määrä väheni, aktiivisten MS-leesioiden määrä laski (50 % > 12 %), potilaiden toimintakyky parantui merkittävästi. Elämänlaadun pisteytyksien (physcical ja mental QOL) parantumista todettiin kaikissa tautimuotoryhmissä (paitsi mental QOL ei muuttunut SP ryhmässä).[71]
MS-taudissa fatiikki on yksi sairauden vaikeimmaksi koetuista oireista, eikä sen mekanismeja tunneta kovinkaan hyvin.[83][84][84][85][86] Fatiikin helpottuminen on todettu eri CCSVI tutkimuksissa ja Malagoni et al esittivätkin, että fatiikki voi olla CCSVI:stä johtuvaa. He kartoittivat 31 MS-tautipotilaan fatiikin tasoa FSS ja MFIS kartoituksella ennen laskimo-operaatiota sekä 1 kk, 6 kk ja 12 kk operaation jälkeen. Operaation jälkeen tehdyissä mittauksissa todettiin fatiikin merkittävää vähenemistä sekä 6 minuutin kävelytestien tulosten parantumista.[72] Marian Simka ja kumppanit kartoittivat myös laskimo-operaatioiden vaikutuksia MS-tautipotilaiden fatiikkiin. Heidän tutkimukseen osallistui 340 MS-tautipotilasta, joiden fatiikki arvioitiin FSS pisteytyksellä ennen operaatiota ja 6 kk operaation jälkeen. Tulosten vertailu osoitti, että fatiikki oli vähentynyt merkittävästi operaation myötä. Tutkijat havaitsivat myös, että erityisesti vaikeaa fatiikkia kokeneilla MS-tautipotilailla oire helpottui keskimääräistä enemmän.[74] Stanfordin yliopiston (USA) tunnettu verisuonikirurgi Michael Dake julkaisi oman pilottitutkimuksensa alustavia tuloksia verisuoniasiantuntijoiden kansainvälisessä konferenssissa (ISET, 2011). Stanfordin operoitiin 30 MS-tautipotilasta ja vuoden kuluttua operaatiosta tehdyssä kartoituksessa todettiin, että MS-fatiikki oli vähentynyt noin puoleen entisestä.[73]
Stanfordin yliopiston lisäksi kolme muutakin yhdysvaltalaista tutkijaryhmää julkaisivat tuloksiaan vuoden 2012 aikana. Kalifornialaistutkijat (Hubbard et al) analysoivat 259 MS-tautipotilaan verenvirtauksia ja operoivat CCSVI-ahtaumia. Hoitotoimenpiteen tuloksellisuutta arvioitin kuukausi ja puoli vuotta operaation jälkeen MSIS-29 mittaristolla (Multiple Sclerosis Impact Scale). Fyysistä ja psyykkistä vaikutusta mittaavan MSIS pisteytyksen mukaan operaatio paransi tilastollisesti merkittävästi MS-tautipotilaiden tilaa. Yhden kuukauden tarkastuskohdassa potilaiden fyysistä tilaa arvioiva MSIS-pisteytys kohosi 67,9 prosentilla potilaista ja kuuden kuukauden kohdalla 53,6 prosentilla potilaista pisteytys osoitti parempaa tilannetta. Psyykkisen osa-alueen MSIS-pisteytys oli kohentunut kuukauden ja kuuden kuukauden kohdalla noin puolella potilaista (53 % ja 44,4 %).[75] Chicagon yliopiston tutkimuksessa (Ferral et al) MS-tautipotilaiden laskimoahtaumia todettiin katetri venografialla 95 %:lla tutkituista MS-tautipotilaista (n=94). Oireiden helpottumista Chicagon tutkijat havaitsivat 55 %:lla operoiduista. Heidän tutkimuksessa hieman vajaalla puolella operoiduista oli MS-taudin progressiivinen tautimuoto.[87] Maaliskuussa 2012 pidetyssä radiologien konferenssissa (San Francisco) New Yorkin tutkimusryhmän edustaja Kenneth Mandato esitteli 192 MS-tautipotilaalle (96 RR, 66 SP, 30 PP) tehdyn operoinnin tuloksia. Laskimo-operaatioiden vaikutuksia mitattiin kyselytutkimuksena, missä kartoitettiin mm. fyysistä toimintakykyä, fatiikkia, seksuaalista toimintakykyä, emotionaalista sekä kognitiivista tilannetta. Tulosten analysointi osoitti, että operoinnista selkeämmin hyötyivät vähemmän aikaa (alle 10 vuotta) MS-tautia sairastaneet. Fyysisen toimintakyvyn osalta kaikkiaan 75 % operoidun kohdalla todettiin parantumista lyhyellä aikavälillä.[81]
Yhdysvaltalaistutkijoiden lisäksi vuonna 2012 julkaistiin kaksi Paolo Zambonin tutkimusryhmän kartoitusta laskimoiden operoinnista. Functional Neurology tiedejulkaisussa esiteltiin tutkimus, missä selviteltiin laskimo-operaation tuloksellisuutta kahden vuoden aikavälillä. Tutkimus kohdentui RR-tautimuotoa sairastaviin MS-potilaisiin, joista 29 tilaa arvioitiin niin laskimoiden virtauksien kuin neurologisen tilan osalta. Pallolaajennuksen hemodynaamista tilaa seurattiin kolmen kuukauden välein tehdyssä ultraääni mittauksessa (Echo Color Doppler). Kahden vuoden aikana 16 MS-tautipotilaan jugulaarilaskimoiden virtaus säilyi hyvänä, mutta 11 potilaan kohdalla operaatio suoritettiin kahdesti ja kahdelle potilaalle kolmesti. MS-taudin pahenemisvaiheiden osalta todettiin tilastollisesti merkittävää vähenemistä; kahden vuoden aikana pahenemisvaiheiden keskiarvo oli 0,45 ja operaatiota edeltävänä kahden vuoden aikajaksona vastaava lukema oli 0,76 (p=0,021). MS-taudin invaliditeettiä osoittava EDSS arvo oli myös laskenut tilastollisesti merkittävästi neljän vuoden aikavälillä; kaksi vuotta ennen operaatiota mitattu ryhmän keskiarvo oli 2,27 ja kaksi vuotta operaation jälkeen ryhmän EDSS pisteiden keskiarvo oli 1,98 (p=0,037). Tutkijoiden mukaan operoitujen tilanteen kohentuminen liittyy todennäköisesti virtausesteiden korjaamiseen ja sen myötä parempaan verenvirtaukseen aivoissa. Tämän tutkimuksen tärkeä havainto oli myös se, että huomattavalla osalla potilaista operoitu kaulan jugulaarilaskimo ahtautuu uudelleen.[76] Edellä mainittuun ongelmaan liittyen laskimosairauksien tiedelehti Phlebology julkaisi tapaustutkimuksen (Zamboni et al), missä italialaisella MS-tautia sairastavalla naisella pallolaajennuksen jälkeen todettiin hyvä hoitovaste, mutta todetut hyödyt katosivat kohtalaisen nopeasti. Kun naisen jugulaarilaskimoita tutkittiin tarkemmin, niin todettiin että kaulan omohyoid-lihas painoi jugulaarilaskimoa, estäen kunnollisen verenvirtauksen. Kyseinen lihas operoitiin kirurgisesti ja potilaan neurologisessa tilassa todettiin selkeä kohentuminen. Kaksi vuotta kirurgisen operaation jälkeen naisen EDSS arvo oli laskenut kaksi pistettä ja potilaan tuntohäiriöt sekä fatiikki olivat poistuneet.[77]
Radak et al toteuttivat kliinisen tutkimuksensa paljolti samanlaisena kuin Zambonin ryhmän pilottitutkimus ja heidän tutkimus julkaistiin 2013 Phlebology lehdessä. Heidän tutkimukseen valittiin 72 MS-tautipotilasta (44 RR, 20 SP, 4 PP sekä 4 benigni), joiden tilaa seurattiin 1 kk, 6 kk ja 12 kk kohdissa. Operaatioiden tulos ilmeni hemodynaamisten mittauksien ja arvojen parantumisena. Zambonin pilottitutkimuksen mallia noudattaen, myös tässä tutkimuksessa todettiin laskimopaineen merkittävä väheneminen jugulaarilaskimossa (P < 0.05). Operaatioiden myötä potilaiden invaliditeettiä osoittava EDSS pistetys väheni merkittävästi (P < 0.01) ja noin puolet operoiduista ilmoitti tilansa kohentumisesta.[88]
Yhdysvallat-Italia yhteistyössä tehty tutkimus (Zivadinov et al) julkaistiin Journal of Vascular and Interventional Radiology:ssa 2013. Tutkimuksen keskiössä oli pallolaajennuksen vaikutus selkäydinnesteen virtaukseen sekä potilaiden neurologiseen tilaan. Pilottitutkimukseen osallistui 15 MS-tautipotilasta, joilla todettiin myös CCSVI. Tutkittavat jaettiin kahteen ryhmään, joista ”välittömästi operoitavat” (8)operoitiin heti tutkimuksen alussa ja loput seitsemän eli viiveryhmä 6 kk kohdalla. Selkäydinnesteen virtaus arvioitiin kaikilta ennen ensimmäistä operaatiota ja mittauksen tulos oli se, että ryhmillä ei ollut merkityksellistä eroa virtauksessa tuolloin. Seuraava mittaus tehtiin 6 kk:n kohdalla ja tuolloin todettiin merkittävä ero operoitujen hyväksi (p=0.001). Tässä pilottitutkimuksessa tutkimuksessa todettiin yhteys hitaamman selkäydinnesteen virtauksen ja MS-taudin kliinisten oireiden ja MRI kuvien suhteen.[89]
Cardiovascular Interventions julkaisi alkuvuodesta 2014 Zorc et al tutkimuksen, missä mitattiin erilaisilla mittareilla (MSIS-29, FSS, MFIS, OAB-V8) laskimoiden operoinnin vaikutuksia MS-tautipotilaiden elämänlaatuun. Yhteensä 72 MS-tautipotilasta operoitiin ja vaikutuksia analysoitiin 3 kk, 6 kk ja 12 kk operaation jälkeen. Tutkimuksessa todettiin erittäin selkeä fatiikin väheneminen FSS mittarilla (p=0,001), MFIS-pisteet (fyysinen, psykologinen, kognitiivinen mittaus) laskivat merkittävästi (p<0.05) ja myös virtsarakon toimintaan mittaava OAB-V8 mittauksen tulos oli vähentynyt (p<0.01). Elämänlaatua mittaavan MSIS-29 pisteet osoittivat myös operoitujen elämänlaadun parantuneen merkittävästi (p>0.01).[90] Toinen 2014 julkaistu (Scalise et al, Phlebology) kliininen tutkimus keskittyi selkeämmin arvioimaan toimenpiteen vaikutuksia verenvirtaukseen. Kaikkiaan 45 MS/CCSVI-potilaalle tehtiin laskimo-operaatio ja tilannetta arvioitiin uudelleen 3 kk operaation jälkeen. Laskimoiden toimintaa kuvaavat arvot (VH ja VHISS) olivat merkittävästi vähentyneet operaation jälkeen, mutta ei kaikilla. Neurologisessa arviossa EDSS arvo oli merkittävästi pienempi kuin ennen operaatiota (−5.5 %, p < 0.001).[80]
Buffalon yliopiston tutkijoiden kontrolloitu kliininen koe endovaskulaarihoidosta ei voinut todentaa CCSVI:n hoidon hyötyä MS-tautia sairastavilla. He pitivät tuloksia odottamattomina ja yllättävinä. Buffalon yliopiston tutkijat esittivät tuloksiaan American Academy of Neurology vuosikokouksessa San Diegossa. Kyseessä oli PREMISe (The Prospective Randomized Endovascular Therapy in MS) tutkimus, joka oli ensimmäinen prospektiivinen randomisoitu ja kontrolloitu tutkimus. Tärkeimmät löydökset tutkimuksessa olivat, että vaikka hoito osoittautui turvalliseksi, ei sillä ollut pysyvää hyötyä potilaiden oireisiin. Tutkimuksen ensimmäisessä vaiheessa tutkittiin hoidon turvallisuutta ja mukana oli 10 MS-tautia sairastavaa. Toisessa vaiheessa mukana oli 20 MS-tautia sairastaa, jotka randomisoitiin joko hoitoryhmään tai plasebohoitoa saaneeseen ryhmään. Hoitoa saaneen ja lume-ryhmän välille ei saatu tutkimuksessa eroa kliinisissä oireissa, MRI kuvauksessa todettavissa pesäkkeissä tai elämän laadussa.[91] PREMISE-tutkimuksessa ei myöskään todettu operaation jälkeen eroa verenvirtauksessa operoitujen ja lume-toimenpide ryhmän kesken. Erityisesti tämä seikka tutkimuksessa herätti kritiikkiä, sillä toimenpiteen tarkoitus on korjata verenvirtausta.[92]
Hoidon riskit ja turvallisuus muokkaa
Vuonna 2012 julkaistiin erään amerikkalaisen tutkimusryhmän seurantatutkimus endovaskulaarihoitojen turvallisuudesta. Tässä tutkimuksessa mukana oli 240 MS-tautipotilasta, joille oli tehty yht 257 toimenpidettä. Kolmea potilasta lukuun ottamatta potilaat voitiin kotiuttaa kolmen tunnin päästä toimenpiteestä. 8,2 % potilaista sai toimenpiteen jälkeen päänsärkyä, joista yhdellä päänsärky kesti yli 30 päivää. Niskakipua ilmaantui 15,6 %:lle potilaista. Kolme potilasta (1,3 %) sai laskimotromboosin, joka vaati uudelleen hoitoon pääsyä 30 päivän sisällä. Kolme potilasta sai rytmihäiriöitä, joista kaksi vaati sairaalahoitoa. Tutkimusryhmä totesi vakavien haittavaikutusten ilmaantuneen 1,6 %:lle hoidetuista. He päätyivät suosittelemaan toimenpiteen jälkeistä ultraääntä varmistamaan stenttien aukiolon.[93] Puolalaisessa tutkimuksessa endovaskulaarihoidoista selvitettiin toimenpiteen turvallisuutta. Tutkimuksessa oli mukana 564 toimenpidettä (pallolaajennus ja stenttaus) ja ne tehtiin 331:lle potilaalle. Stenttitromboosi ilmaantui 1,2 %:lle stenttioperaatioista ja yhdellä potilaalla jouduttiin kirurgisesti poistamaan pallolaajennusväline. Vähäisempiä haittavaikutuksia ilmaantui 2,4 %:ssa tapauksia.[94]
Italialaisessa tutkimuksessa kartoitettiin endovaskulaariseen hoitoon liittyviä riskejä. Tutkimuksessa koottiin yhteen 462 toimenpiteen yhteydessä tulleita vakavia haittavaikutuksia. 15 potilasta eli 3,25 % oli saanut haittoja. Yleisimpänä haittavaikutuksena oli jugularistromboosi, jonka sai seitsemän potilasta.[95] Tšekkiläisessä tapauskertomuksessa kuvattiin endovaskulaarisen hoidon jälkeen tulleita ongelmia. Kyseessä oli 51-vuotias nainen, jolla vuonna 1998 oli todettu MS-tauti. Hänelle tehtiin endovaskulaarihoito 2010, jonka yhteydessä asennettiin kolme stenttiä. Toimenpiteen jälkeen hänelle tuli oikean puoleista niskakipua. Kuvantamistutkimuksissa todettiin kahden stentin olleen pois paikaltaan oikealla puolella ja vasemman puoleisen stentin trombosoituminen. EDSS mittarilla hänen neurologinen toimintakykynsä oli huonontunut toimenpiteen jälkeen.[96]
Eri puolilla maailmaa on meneillään erilaisia tutkimuksia, ja niitä julkaistaan melko usein. Merkittävimpänä tutkimuksena voidaan pitää Italian laajaa plasebokontrolloitua tutkimusta, joka tunnetaan nimellä Brave Dreams. Tähän usean klinikan laajaan tutkimukseen osallistuu 679 MS-tautipotilasta, joista osalle tehdään oikea operaatio ja osalle ei (sham operation). Tutkittavia seurataan ja arvioidaan monella tavoin vuoden ajan. Tutkimuksen aikataulu on muuttunut, joten tarkkaa aikataulua tutkimuksen valmistumisesta ei ole tiedossa.[97]
Lähteet muokkaa
- ↑ a b c d Zamboni P1, Galeotti R, Menegatti E, Malagoni AM, Tacconi G, Dall'Ara S, Bartolomei I, Salvi F. Chronic cerebrospinal venous insufficiency in patients with multiple sclerosis. J Neurol Neurosurg Psychiatry. 2009 Apr;80(4):392-9. doi: 10.1136/jnnp.2008.157164. Epub 2008 Dec 5.
- ↑ a b Andreas Laupacis, Erin Lillie, Andrew Dueck, Sharon Straus, Laure Perrier,Jodie M. Burton, Richard Aviv, Kevin Thorpe, Thomas Feasby and Julian Spears. Association between chronic cerebrospinal venous insufficiency and multiple sclerosis: a meta-analysis. CMAJ November 8, 2011 vol. 183 no. 16. doi: 10.1503/cmaj.111074
- ↑ a b A Thapar, T Lane, R Nicholas, T Friede, M Ellis, J Assenheim, I J Franklin and A H Davies. Systematic review of sonographic chronic cerebrospinal venous insufficiency findings in multiple sclerosis. Phlebology December 2011 vol. 26 no. 8 319-325. doi: 10.1258/phleb.2011.011098
- ↑ a b Zwischenberger BA, Beasley MM, Davenport DL, Xenos ES. Meta-analysis of the correlation between chronic cerebrospinal venous insufficiency and multiple sclerosis. Vasc Endovascular Surg. 2013 Nov;47(8):620-4. doi: 10.1177/1538574413503562. Epub 2013 Sep 4.
- ↑ http://www.vascularspecialistonline.com/specialty-focus/venous-diseases/single-article-page/ccsvi-controversy-a-call-for-new-research.html[vanhentunut linkki]
- ↑ a b P.M. Bavera, Training and Learning Curve in Chronic Cerebrospinal Venous Insufficiency Assessment. American Journal of Neuroradiology. 2013, doi: 10.3174/ajnr.A3570
- ↑ Lee BB, Baumgartner I, Berlien P, Bianchini G, Burrows P, Gloviczki P, Huang Y, Laredo J, Loose DA, Markovic J, Mattassi R, Parsi K, Rabe E, Rosenblatt M, Shortell C, Stillo F, Vaghi M, Villavicencio L, Zamboni P. Diagnosis and Treatment of Venous Malformations Consensus Document of the International Union of Phlebology (IUP): updated 2013. Int Angiol. 2014 Feb 25. PMID 24566499
- ↑ Byung-Boong LEE. Venous embryology: the key to understanding anomalous venous conditions. Phlebolymphology. 2012;19(4):170-1
- ↑ Al-Omari MH1, Al-Bashir A. Internal jugular vein valve morphology in the patients with chronic cerebrospinal venous insufficiency (CCSVI); angiographic findings and schematic demonstrations. Rev Recent Clin Trials. 2012 May;7(2):83-7.
- ↑ Paolo Zamboni, Erica Menegatti, Savino Occhionorelli, Fabrizio Salvi. The controversy on chronic cerebrospinal venous insufficiency. Veins and Lymphatics 2013; volume 2:e14, 43-48. DOI: http://dx.doi.org/10.4081/vl.2013.e14.
- ↑ C. Diaconu, S. Staugaitis, J. McBride, C. Schwanger, A. Rae-Grant, R. Fox. Anatomical and histological analysis of venous structures associated with chronic cerebro-spinal venous insufficiency. 5th Joint triennial congress of the European and Americas Committees for Treatment and Research in Multiple Sclerosis Amsterdam, The Netherlands.
- ↑ Andrea Baiocchini, Raffaele Toscano, Wilfredo von Lorch and Franca Del Nonno. Anatomical stenosis of the internal jugular veins : supportive evidence of chronic cerebrospinal venous insufficiency ? J Neurol Neurosurg Psychiatry 2011;82:4 355 doi:10.1136/jnnp.2010.228098
- ↑ Radak Djordje, Ilijevski Nenad, Kolar Jovo, Sagić Dragan, Antonić Želimir, Tanasković Slobodan, Aleksić Nikola, Babić Srdjan, Otašević Petar. Incidence and distribution of compression of extracranial venous pathway in patients with chronic cerebrospinal venous insufficiency and multiple sclerosis. Phlebology August 2014 vol. 29 no. 7 476-479. doi:10.1177/0268355513486638
- ↑ Sergio Gianesini, Erica Menegatti, Francesco Mascoli, Fabrizio Salvi, Stefano Bastianello, Paolo Zamboni. The omohyoid muscle entrapment of the internal jugular vein. A still unclear pathogenetic mechanism. Phlebology October 2014 vol. 29 no. 9 632-635. doi: 10.1177/0268355513489549
- ↑ Matteo Coena, Erica Menegattib, Fabrizio Salvi, Francesco Mascolid, Paolo Zamboni, Giulio Gabbiania, Marie-Luce Bochaton-Piallata. Altered collagen expression in jugular veins in multiple sclerosis. Cardiovascular Pathology, Volume 22, Issue 1, January–February 2013, Pages 33–38.
- ↑ Zamboni P, Tisato V, Menegatti E, Mascoli F, Gianesini S, Salvi F, Secchiero P. Ultrastructure of internal jugular vein defective valves. Phlebology. 2014 Jun 27. pii: 0268355514541980.
- ↑ Lorella Pascolo, Alessandra Gianoncelli, Clara Rizzardi, Veronica Tisato, Murielle Salomé, Carla Calligaro, Fabrizio Salvi, David Paterson & Paolo Zamboni. Calcium micro-depositions in jugular truncular venous malformations revealed by Synchrotron-based XRF imaging. Scientific Reports 4, Article number:6540. doi:10.1038/srep06540
- ↑ Massimiliano Farina, Eugenio Novelli and Raffaello Pagani. Cross-sectional area variations of internal jugular veins during supine head rotation in multiple sclerosis patients with chronic cerebrospinal venous insufficiency: a prospective diagnostic controlled study with duplex ultrasound investigation. BMC Neurology 2013, 13:162. doi:10.1186/1471-2377-13-162
- ↑ Zamboni P, Consorti G, Galeotti R, Gianesini S, Menegatti E, Tacconi G, Carinci F. Venous collateral circulation of the extracranial cerebrospinal outflow routes. Curr Neurovasc Res. 2009 Aug;6(3):204-12. Epub 2009 Aug 1. PMID 19534716. http://dx.doi.org/10.1155/2013/598093
- ↑ Lupattelli T1, Benassi F, Righi E, Bavera P, Bellagamba G. Percutaneous transluminal angioplasty in a patient with chronic cerebrospinal venous insufficiency and persistent left superior vena cava. Phlebology. 2014 Apr;29(3):200-2. doi: 10.1258/phleb.2012.012040.
- ↑ a b Marcello Mancini, Roberta Lanzillo, Raffaele Liuzzi, Orlando Di Donato, Monica Ragucci, Serena Monti, Elena Salvatore, Vincenzo Brescia Morra, and Marco Salvatore. Internal Jugular Vein Blood Flow in Multiple Sclerosis Patients and Matched Controls PLoS One. 2014; 9(3): e92730. Published online Mar 27, 2014. doi:10.1371/journal.pone.0092730
- ↑ a b Pierfrancesco Veroux, Alessia Giaquinta, Debora Perricone, Lorenzo Lupo, Flavia Gentile, Carla Virgilio, Anna Carbonaro, Concetta De Pasquale, Massimiliano Veroux. Internal Jugular Veins Outflow in Patients with Multiple Sclerosis: A Catheter Venography Study. Journal of Vascular and Interventional Radiology, Volume 24, Issue 12, Pages 1790–1797, December 2013. DOI: http://dx.doi.org/10.1016/j.jvir.2013.08.024
- ↑ Balloon Angioplasty Improves Venous Flow in MS Patients. Clinical Neurology News. June 11, 2012. http://www.clinicalneurologynews.com/index.php?id=9985&type=98&tx_ttnews[tt_news]=134549&cHash=da03e20e36[vanhentunut linkki]
- ↑ Swank RL, Roth JG, Woody DC Jr. Cerebral blood flow and red cell delivery in normal subjects and in multiple sclerosis. Neurol Res. 1983;5(1):37-59.
- ↑ Meng Law, Amit M. Saindane, Yulin Ge, James S. Babb, Glyn Johnson, PhD, Lois J. Mannon, Joseph Herbert, Robert I. Grossman. Microvascular Abnormality in Relapsing-Remitting Multiple Sclerosis: Perfusion MR Imaging Findings in Normal-appearing White Matter. RSNA Radiology, June 2004, Volume 231, Issue 3. DOI: http://dx.doi.org/10.1148/radiol.2313030996.
- ↑ Sumita Adhyaa, Glyn Johnsona, Joseph Herbertb, Hina Jaggia, James S. Babba, Robert I. Grossmana, Matilde Inglesea. Pattern of hemodynamic impairment in multiple sclerosis: Dynamic susceptibility contrast perfusion MR imaging at 3.0 T. NeuroImage, Volume 33, Issue 4, December 2006, Pages 1029–1035. doi:10.1016/j.neuroimage.2006.08.008.
- ↑ De Keyser, Steen C, Mostert JP, Koch MW. Hypoperfusion of the cerebral white matter in multiple sclerosis: possible mechanisms and pathophysiological significance. J Cereb Blood Flow Metab. 2008 Oct;28(10):1645-51. doi: 10.1038/jcbfm.2008.72.
- ↑ Zamboni P, Menegatti E, Weinstock-Guttman B, Dwyer MG, Schirda CV, Malagoni AM, Hojnacki D, Kennedy C, Carl E, Bergsland N, Magnano C, Bartolomei I, Salvi F, Zivadinov R.Hypoperfusion of brain parenchyma is associated with the severity of chronic cerebrospinal venous insufficiency in patients with multiple sclerosis: a cross-sectional preliminary report. BMC Med. 2011 Mar 7;9:22. doi: 10.1186/1741-7015-9-22.
- ↑ Zivadinov R, Poloni GU, Marr K, Schirda CV, Magnano CR, Carl E, Bergsland N, Hojnacki D, Kennedy C, Beggs CB, Dwyer MG, Weinstock-Guttman. Decreased brain venous vasculature visibility on susceptibility-weighted imaging venography in patients with multiple sclerosis is related to chronic cerebrospinal venous insufficiency. BMC Neurol. 2011 Oct 19;11:128. doi: 10.1186/1471-2377-11-128.
- ↑ Adams CW. Perivascular iron deposition and other vascular damage in multiple sclerosis. J Neurol Neurosurg Psychiatry. 1988 Feb;51(2):260-5. PMCID: PMC1031540.
- ↑ Craelius W, Migdal MW, Luessenhop CP, Sugar A, Mihalakis I. Iron deposits surrounding multiple sclerosis plaques. Arch Pathol Lab Med. 1982 Aug;106(8):397-9. PMID 6896630
- ↑ Zhang Y1, Metz LM, Yong VW, Mitchell JR. 3T deep gray matter T2 hypointensity correlates with disability over time in stable relapsing-remitting multiple sclerosis: a 3-year pilot study. J Neurol Sci. 2010 Oct 15;297(1-2):76-81. doi: 10.1016/j.jns.2010.07.014.
- ↑ Valberg LS1, Flanagan PR, Kertesz A, Ebers GC. Abnormalities in iron metabolism in multiple sclerosis. Can J Neurol Sci. 1989 May;16(2):184-6.
- ↑ Grabner G1, Dal-Bianco A, Schernthaner M, Vass K, Lassmann H, Trattnig S. Analysis of multiple sclerosis lesions using a fusion of 3.0 T FLAIR and 7.0 T SWI phase: FLAIR SWI. J Magn Reson Imaging. 2011 Mar;33(3):543-9. doi: 10.1002/jmri.22452.
- ↑ Hagemeier J1, Weinstock-Guttman B, Heininen-Brown M, Poloni GU, Bergsland N, Schirda C, Magnano CR, Kennedy C, Carl E, Dwyer MG, Minagar A, Zivadinov R. Gray matter SWI-filtered phase and atrophy are linked to disability in MS. Front Biosci (Elite Ed). 2013 Jan 1;5:525-32.
- ↑ Al-Radaideh AM1, Wharton SJ, Lim SY, Tench CR, Morgan PS, Bowtell RW, Constantinescu CS, Gowland PA. Increased iron accumulation occurs in the earliest stages of demyelinating disease: an ultra-high field susceptibility mapping study in Clinically Isolated Syndrome. Mult Scler. 2013 Jun;19(7):896-903. doi: 10.1177/1352458512465135.
- ↑ Zamboni P. The big idea: iron-dependent inflammation in venous disease and proposed parallels in multiple sclerosis. J R Soc Med. 2006 Nov;99(11):589-93
- ↑ Zivadinov R1, Schirda C, Dwyer MG, Haacke ME, Weinstock-Guttman B, Menegatti E, Heininen-Brown M, Magnano C, Malagoni AM, Wack DS, Hojnacki D, Kennedy C, Carl E, Bergsland N, Hussein S, Poloni G, Bartolomei I, Salvi F, Zamboni P. Chronic cerebrospinal venous insufficiency and iron deposition on susceptibility-weighted imaging in patients with multiple sclerosis: a pilot case-control study. Int Angiol. 2010 Apr;29(2):158-75. PMID 20351672.
- ↑ Ajay Vikram Singh and Paolo Zamboni. Anomalous venous blood flow and iron deposition in multiple sclerosis. Journal of Cerebral Blood Flow & Metabolism (2009) 29, 1867–1878;
- ↑ Haacke EM, Garbern J, Miao Y, Habib C, Liu M. Iron stores and cerebral veins in MS studied by susceptibility weighted imaging. Int Angiol. 2010 Apr;29(2):149-57. PMID 20351671
- ↑ R. Zivadinov, C. Magnano, R. Galeotti, C. Schirda, B. Weinstock-Guttman, E. Menegatti, J. Hagemeier, A.M. Malagoni, D. Hojnacki, C. Kennedy, I. Bartolomei, C. Beggs, F. Salvi, P. Zamboni. Cine cerebrospinal fluid imaging changes in patients with multiple sclerosis after venous angioplasty. A 1-year follow-up study. ECTRIMS Congress 2012, Lyon.
- ↑ d'Alessandro A, Mandolesi S, Niglio T, Orsini A, Di Cello P, Pelle F, Mora F, d'Alessandro A, Mandolesi D, Fedele F. Increased size of third ventricle in patients with multiple sclerosis and chronic cerebrospinal venous insufficiency. Journal of Vascular Diagnostics, September 2014 Volume 2014:2 Pages 91—97. DOI http://dx.doi.org/10.2147/JVD.S56519
- ↑ Zamboni P, Morovic S, Menegatti E, Viselner G, Nicolaides AN. Screening for chronic cerebrospinal venous insufficiency (CCSVI) using ultrasound--recommendations for a protocol. Int Angiol. 2011 Dec;30(6):571-97.
- ↑ a b Bavera P. M. Agus G. B., Alpini D., Cecconi P., Guazzoni A., Tori A., Costantini E., Lupattelli T. Results from 823 consecutive Duplex exams for CCSVI in a Vascular Centre. Acta Phlebologica 2012 December;13(3):141-8.
- ↑ Robert Zivadinov, Stefano Bastianello, Michael D. Dake, Hector Ferral, E. Mark Haacke, Ziv J Haskal, David Hubbard, Nikolaos Liasis, Kenneth Mandato, Salvatore Sclafani, Adnan H. Siddiqui, Marian Simka, Paolo Zamboni. Recommendations for Multimodal Noninvasive and Invasive Screening for Detection of Extracranial Venous Abnormalities Indicative of Chronic Cerebrospinal Venous Insufficiency: A Position Statement of the International Society for Neurovascular Disease. Journal of Vascular and Interventional Radiology, Volume 25, Issue 11, Pages 1785–1794.e17, November 2014. DOI: http://dx.doi.org/10.1016/j.jvir.2014.07.024
- ↑ Zamboni P1, Menegatti E, Galeotti R, Malagoni AM, Tacconi G, Dall'Ara S, Bartolomei I, Salvi F. The value of cerebral Doppler venous haemodynamics in the assessment of multiple sclerosis. J Neurol Sci. 2009 Jul 15;282(1-2):21-7. doi: 10.1016/j.jns.2008.11.027.
- ↑ L Tromba, S Blasi, A Vestri, D Kiltzanidi, F Tartaglia, A Redler. Prevalence of chronic cerebrospinal venous insufficiency in multiple sclerosis: a blinded sonographic evaluation. Phlebology November 15, 2013. doi: 10.1177/0268355513512823
- ↑ Stefano Bastianello, Alfredo Romani, Gisela Viselner, Enrico Colli Tibaldi, Elisabetta Giugni, Marta Altieri, Pietro Cecconi, Laura Mendozzi, Massimiliano Farina, Donatella Mariani, Antonio Galassi, Claudio Quattrini, Marcello Mancini, Vincenzo Bresciamorra, Angela Lagace, Sandy McDonald, Giorgio Bono, and Roberto. Chronic cerebrospinal venous insufficiency in multiple sclerosis: clinical correlates from a multicentre study. BMCNeurology 2011, 11:132.
- ↑ Simka M1, Kostecki J, Zaniewski M, Majewski E, Hartel M. Extracranial Doppler sonographic criteria of chronic cerebrospinal venous insufficiency in the patients with multiple sclerosis. Int Angiol. 2010 Apr;29(2):109-14. PMID 20351666
- ↑ Simka M1, Latacz P, Ludyga T, Kazibudzki M, Swierad M, Janas P, Piegza J. Prevalence of extracranial venous abnormalities: results from a sample of 586 multiple sclerosis patients. Funct Neurol. 2011 Oct-Dec;26(4):197-203.
- ↑ Paolo Zamboni, Erica Menegatti, Paolo Conforti, Simon Shepherd, Mirko Tessari, Clive Beggs. Assessment of cerebral venous return by a novel plethysmography method. Journal of Vascular Surgery. Volume 56, Issue 3, Pages 677–685.e1. DOI: http://dx.doi.org/10.1016/j.jvs.2012.01.074
- ↑ NASA: Strain-gauge Plethysmographic Analysis of the CErebral DRainage Experimented and Assessed in the Micro-gravitational Setting (Drain Brain) - 10.14.14 http://www.nasa.gov/mission_pages/station/research/experiments/1278.html
- ↑ Lanzillo R, Mancini M, Liuzzi R, Di Donato O, Salvatore E, Maglio V, Vacca G, Amato L, D'Anna G, Brunetti A, Brescia Morra V. Chronic cerebrospinal venous insufficiency in multiple sclerosis: a highly prevalent age-dependent phenomenon.BMC Neurol. 2013 Feb 13;13:20. doi: 10.1186/1471-2377-13-20.
- ↑ Clin Neurol Neurosurg. 2013 Aug;115(8):1394-8. doi: 10.1016/j.clineuro.2013.01.003. Epub 2013 Feb 4. Chronic cerebrospinal venous insufficiency in multiple sclerosis: A sonographer-blinded case-control study. Imperiale D, Melis F, Giaccone C, Guido M, Milano E, Buffa C, Appendino L.
- ↑ Rodger IW, Dilar D, Dwyer J, Bienenstock J, Coret A, et al. (2013) Evidence against the Involvement of Chronic Cerebrospinal Venous Abnormalities in Multiple Sclerosis. A Case-Control Study. PLoS ONE 8(8): e72495. doi:10.1371/journal.pone.0072495
- ↑ http://www.hs.fi/tiede/Tutkijat+tyrm%C3%A4%C3%A4v%C3%A4t+kohutun+MS-tautiteorian/a1377048348042 (Arkistoitu – Internet Archive)
- ↑ Leone MA, Raymkulova O, Naldi P, Lochner P, Bolamperti L, Coppo L, Stecco A, Liboni W. Chronic cerebrospinal venous insufficiency is not associated with multiple sclerosis and its severity: a blind-verified study.PLoS One. 2013;8(2):e56031. doi: 10.1371/journal.pone.0056031. Epub 2013 Feb 13.
- ↑ Floris R, Centonze D, Fabiano S, Stefanini M, Marziali S, Del Giudice C, Reale CA, Castelli M, Garaci F, Melis M, Gandini R, Simonetti G.Prevalence study of chronic cerebrospinal venous insufficiency in patients with multiple sclerosis: preliminary data.Radiol Med. 2012 Aug;117(5):855-64. doi: 10.1007/s11547-011-0767-5. Epub 2012 Jan 7
- ↑ Barreto AD, Brod SA, Bui TT, Jemelka JR, Kramer LA, Ton K, Cohen AM, Lindsey JW, Nelson F, Narayana PA, Wolinsky JS.Chronic cerebrospinal venous insufficiency: Case-control neurosonography results.Ann Neurol. 2013 Jun;73(6):721-8. doi: 10.1002/ana.23839. Epub 2013 Feb 26.
- ↑ Blinkenberg M, Akeson P, Sillesen H, Lövgaard S, Sellebjerg F, Paulson OB, Siebner HR, Sørensen PS.Chronic cerebrospinal venous insufficiency and venous stenoses in multiple sclerosis.Acta Neurol Scand. 2012 Dec;126(6):421-7. doi: 10.1111/j.1600-0404.2012.01671.x. Epub 2012 Apr 25.
- ↑ Doepp F, Würfel JT, Pfueller CF, Valdueza JM, Petersen D, Paul F, Schreiber SJ.Venous drainage in multiple sclerosis: a combined MRI and ultrasound study.Neurology. 2011 Nov 8;77(19):1745-51. doi: 10.1212/WNL.0b013e318236f0ea. Epub 2011 Oct 26.
- ↑ Mayer CA, Pfeilschifter W, Lorenz MW, Nedelmann M, Bechmann I, Steinmetz H, Ziemann U.The perfect crime? CCSVI not leaving a trace in MS.J Neurol Neurosurg Psychiatry. 2011 Apr;82(4):436-40. doi: 10.1136/jnnp.2010.231613. Epub 2011 Feb 4.
- ↑ Meyer-Schwickerath R, Haug C, Hacker A, Fink F, Seidel D, Hartung HP, Haupts MR.Intracranial venous pressure is normal in patients with multiple sclerosis.Mult Scler. 2011 May;17(5):637-8. doi: 10.1177/1352458510395982. Epub 2011 Jan 12.
- ↑ Doepp F, Paul F, Valdueza JM, Schmierer K, Schreiber SJ.No cerebrocervical venous congestion in patients with multiple sclerosis.Ann Neurol. 2010 Aug;68(2):173-83. doi: 10.1002/ana.22085.
- ↑ Tsivgoulis G, Mantatzis M, Bogiatzi C, Vadikolias K, Voumvourakis K, Prassopoulos P, Piperidou C, Heliopoulos I.Extracranial venous hemodynamics in multiple sclerosis: a case-control study.Neurology. 2011 Sep 27;77(13):1241-5. doi: 10.1212/WNL.0b013e318230a149. Epub 2011 Aug 17.
- ↑ Auriel E, Karni A, Bornstein NM, Nissel T, Gadoth A, Hallevi H.Extra-cranial venous flow in patients with multiple sclerosis.J Neurol Sci. 2011 Oct 15;309(1-2):102-4. doi: 10.1016/j.jns.2011.07.005. Epub 2011 Aug 4.
- ↑ Simka M, Ludyga T, Kazibudzki M, Latacz P, Swierad M.Multiple sclerosis, an unlikely cause of chronic cerebrospinal venous insufficiency: retrospective analysis of catheter venography.JRSM Short Rep. 2012 Aug;3(8):56. doi: 10.1258/shorts.2011.010146. Epub 2012 Aug 17.
- ↑ Worthington V, Killestein J, Eikelenboom MJ, Teunissen CE, Barkhof F, Polman CH, Uitdehaag BM, Petzold A.Normal CSF ferritin levels in MS suggest against etiologic role of chronic venous insufficiency.Neurology. 2010 Nov 2;75(18):1617-22. doi: 10.1212/WNL.0b013e3181fb449e. Epub 2010 Sep 29.
- ↑ Atkinson W, Forghani R, Wojtkiewicz GR, Pulli B, Iwamoto Y, Ueno T, Waterman P, Truelove J, Oklu R, Chen JW.Ligation of the jugular veins does not result in brain inflammation or demyelination in mice.PLoS One. 2012;7(3):e33671. doi: 10.1371/journal.pone.0033671. Epub 2012 Mar 21.
- ↑ Zamboni, Paolo. Comment on "Ligation of the jugular veins does not result in brain inflammation or demyelination in mice". PLoS One. 2012;7(3):e33671. doi: 10.1371/journal.pone.0033671. Epub 2012 Mar 21
- ↑ a b c Zamboni P1, Galeotti R, Menegatti E, Malagoni AM, Gianesini S, Bartolomei I, Mascoli F, Salvi F. A prospective open-label study of endovascular treatment of chronic cerebrospinal venous insufficiency. J Vasc Surg. 2009 Dec;50(6):1348-58.e1-3. doi: 10.1016/j.jvs.2009.07.096.
- ↑ a b Malagoni AM1, Galeotti R, Menegatti E, Manfredini F, Basaglia N, Salvi F, Zamboni P. Is chronic fatigue the symptom of venous insufficiency associated with multiple sclerosis? A longitudinal pilot study. Int Angiol. 2010 Apr;29(2):176-82. PMID 20351673
- ↑ a b Controversial MS Treatment Lessens Fatigue, Research At ISET 2011 Shows. Medical News Today. 19 jan 2011. http://www.medicalnewstoday.com/releases/214087.php
- ↑ a b Marian Simka, Piotr Janas, Tomasz Ludyga, Paweł Latacz, Marek Kazibudzki. Endovascular Treatment for Chronic Cerebrospinal Venous Insufficiency in Patients with Multiple Sclerosis. Vascular disease management, 09/05/12
- ↑ a b David Hubbard, Donald Ponec, Justin Gooding, Richard Saxon, Heidi Sauder, Mark Haacke. Clinical Improvement after Extracranial Venoplasty in Multiple Sclerosis. Journal of Vascular and Interventional Radiology, Volume 23, Issue 10, Pages 1302–1308. DOI: http://dx.doi.org/10.1016/j.jvir.2012.07.010
- ↑ a b Salvi F, Bartolomei I, Buccellato E, Galeotti R, Zamboni P. Venous angioplasty in multiple sclerosis: neurological outcome at two years in a cohort of relapsing-remitting patients. Funct Neurol. 2012 Jan-Mar;27(1):55-9. PMCID: PMC3812752
- ↑ a b Gianesini S, Menegatti E, Mascoli F, Salvi F, Bastianello S, Zamboni P. The omohyoid muscle entrapment of the internal jugular vein. A still unclear pathogenetic mechanism. Phlebology. 2014 Oct;29(9):632-5. doi: 10.1177/0268355513489549. Epub 2013 May 16.
- ↑ Salvatore Spagnolo, Filippo Scalise, Luciano Barbato, Maria Antonietta Grasso, Ugo F. Tesler. Bilateral Surgical Reconstruction for Internal Jugular Veins Disease in Patients with Chronic Cerebrospinal Venous Insufficiency and Associated Multiple Sclerosis. Annals of Vascular Surgery Volume 28, Issue 7, Pages 1793.e1–1793.e4, October 2014. DOI: http://dx.doi.org/10.1016/j.avsg.2014.03.012
- ↑ Marjeta Zorc1; Miro Denislic2; Zoran Milosevic3; Rok Zorec1; Dean Ravnik1; Ruda Zorc Pleskovic1; Ales Pleskovic3; Oscar Mendiz4 Impact of Veins Endovascular Procedures on the Quality of Life in Patients with Multiple Sclerosis. Cardiovascular Interventions, J Am Coll Cardiol Intv. 2014;7(2_S):S34-S34. doi:10.1016/j.jcin.2014.01.086.
- ↑ a b Filippo Scalise, Eugenio Novelli, Massimiliano Farina, Luciano Barbato, Salvatore Spagnolo. Venous Hemodynamic Insufficiency Severity Score variation after endovascular treatment of chronic cerebrospinal venous insufficiency. Phlebology February 14, 2014. doi: 10.1177/0268355514524193
- ↑ a b Interventional Radiologists See ‘Significant’ Symptom Relief in MS patients. Society of Interventional Radiology’s 37th Annual Scientific Meeting. http://www.sirweb.org/news/newsPDF/Release_48_Mandato_MS_final.pdf (Arkistoitu – Internet Archive)
- ↑ Mitigating Symptoms, Improving Quality of Life of MS Patients. Society of Interventional Radiology. Sun, Mar 25, 2012. http://news.cision.com/society-of-interventional-radiology/r/mitigating-symptoms--improving-quality-of-life-of-ms-patients,c9232953
- ↑ G Giovannoni. Multiple sclerosis related fatigue. J Neurol Neurosurg Psychiatry. Jan 2006; 77(1): 2–3. doi:10.1136/jnnp.2005.074948
- ↑ a b Bakshi R. Fatigue associated with multiple sclerosis: diagnosis, impact and management. Mult Scler. 2003 Jun;9(3):219-27.
- ↑ G. Comi, L. Leocani, P. Rossi, B. Colombo. Physiopathology and treatment of fatigue in multiple sclerosis. Journal of Neurology, March 2001, Volume 248, Issue 3, pp 174-179.
- ↑ Tiffany J. Braley and Ronald D. Chervin. Fatigue in Multiple Sclerosis: Mechanisms, Evaluation, and Treatment Sleep. Aug 1, 2010; 33(8): 1061–1067. PMCID: PMC2910465
- ↑ Mitigating Symptoms, Improving Quality of Life of MS Patients. Society of Interventional Radiology. Sun, Mar 25, 2012. http://news.cision.com/society-of-interventional-radiology/r/mitigating-symptoms--improving-quality-of-life-of-ms-patients,c9232953
- ↑ Radak D1, Kolar J2, Sagic D1, Ilijevski N1, Tanaskovic S3, Aleksic N2, Marinkovic J4, Mitrasinovic A2, Radak S2, Babic S2, Matic P2, Vlajinac H5. Percutaneous angioplasty of internal jugular and azygous veins in patients with chronic cerebrospinal venous insufficiency and multiple sclerosis: early and mid-term results. Phlebology. 2013 May 3;29(6):367-375.
- ↑ Zivadinov R, Magnano C, Galeotti R, Schirda C, Menegatti E, Weinstock-Guttman B, Marr K, Bartolomei I, Hagemeier J, Malagoni AM, Hojnacki D, Kennedy C, Carl E, Beggs C, Salvi F, Zamboni P. Changes of cine cerebrospinal fluid dynamics in patients with multiple sclerosis treated with percutaneous transluminal angioplasty: a case-control study. J Vasc Interv Radiol. 2013 Jun;24(6):829-38. doi: 10.1016/j.jvir.2013.01.490. Epub 2013 Mar 21.
- ↑ Marjeta Zorc1; Miro Denislic2; Zoran Milosevic3; Rok Zorec1; Dean Ravnik1; Ruda Zorc Pleskovic1; Ales Pleskovic3; Oscar Mendiz4 Impact of Veins Endovascular Procedures on the Quality of Life in Patients with Multiple Sclerosis. Cardiovascular Interventions, J Am Coll Cardiol Intv. 2014;7(2_S):S34-S34. doi:10.1016/j.jcin.2014.01.086
- ↑ http://www.buffalo.edu/news/releases/2013/03/021.html
- ↑ Ashton Embry, DIRECT-MS, April, 2013. The Actual Data from PREMiSe Do Not Support the Highly Publicized, Anti-CCSVI Claims and Warnings of the University of Buffalo Researchers. http://www.direct-ms.org/sites/default/files/Embry%20Premise%20Evaluation%20April%202013.pdf (Arkistoitu – Internet Archive)
- ↑ Mandato KD, Hegener PF, Siskin GP, Haskal ZJ, Englander MJ, Garla S, Mitchell N, Reutzel L, Doti C.Safety of endovascular treatment of chronic cerebrospinal venous insufficiency: a report of 240 patients with multiple sclerosis.J Vasc Interv Radiol. 2012 Jan;23(1):55-9. doi: 10.1016/j.jvir.2011.09.019. Epub 2011 Nov 15.
- ↑ Ludyga T, Kazibudzki M, Simka M, Hartel M, Swierad M, Piegza J, Latacz P, Sedlak L, Tochowicz M.Endovascular treatment for chronic cerebrospinal venous insufficiency: is the procedure safe?Phlebology. 2010 Dec;25(6):286-95. doi: 10.1258/phleb.2010.010053.
- ↑ Ghezzi A, Annovazzi P, Amato MP, Capello E, Cavalla P, Cocco E, Falcini M, Gallo A, Patti F, Perini P, Rodegher ME, Rovaris M, Rottoli MR, Comi G; MS Study Group-Italian Society of Neurology.Adverse events after endovascular treatment of chronic cerebro-spinal venous insufficiency (CCSVI) in patients with multiple sclerosis.Mult Scler. 2013 Jun;19(7):961-3. doi: 10.1177/1352458513475491. Epub 2013 Feb 4.
- ↑ Doležal O, Horáková D, Gdovinová Z, Szilasiová J.Serious complication of percutaneous angioplasty with stent implantation in so called "chronic cerebrospinal venous insufficiency" in multiple sclerosis patient.Prague Med Rep. 2012;113(4):289-93.
- ↑ http://clinicaltrials.gov/ct2/show/study/NCT01371760