Raoultin laki
Raoultin laki on François-Marie Raoultin esittämä fysikaalinen malli, jonka mukaan ideaaliliuoksessa kunkin aineen osapaine on suoraan verrannollinen sen mooliosuuteen seoksesta ja sen höyrynpaineeseen puhtaana.[1] Hyvin harva neste-neste-liuos noudattaa Raoultin lakia edes sinne päin, koska malli olettaa, että komponenttien keskinäiset koheesiovoimat (A–B) ovat yhtä suuret kuin kunkin komponentin koheesiovoimat puhtaana (A–A ja B–B), mikä pitää harvoin paikkaansa. Erittäin niukkaliukoisille aineille, kuten ilman kaasuille vedessä, käytetään Henryn lakia.
Kaavana ilmaistuna kunkin aineen osapaine on:
missä on aineen höyrynpaine puhtaana ja on aineen mooliosuus, joten koko liuoksen (aineet A, B, ...) höyrynpaine on:
Raoultin laista voidaan johtaa esimerkiksi se, että suolaliuoksen kiehumispiste on korkeampi kuin puhtaan veden. Suolan höyrynpaine on nolla, mutta suolan mooliosuus ei, joten se on pois veden mooliosuudesta. Siten kokonaishöyrynpaine tulee vain vedestä:
Alemman höyrynpaineen takia liuosta pitää lämmittää vastaavasti korkeampaan lämpötilaan, jotta sen paine riittää kuplien tuottamiseen eli kiehumiseen.
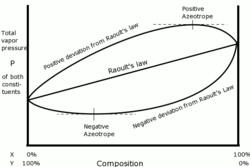
Reaaliseokset poikkeavat Raoultin laista sekä positiivisesti että negatiivisesti. Negatiivinen poikkeama tarkoittaa, että seos on vähemmän haihtuvaa kuin komponentit sinänsä, ja kertoo sen, että molekyylien välille muodostuu jokin spesifinen vetovoima. Esimerkiksi kloroformin ja asetonin välille muodostuu vetysidos, jolloin seos on vähemmän haihtuvampi. Positiivinen poikkeama vastaavasti tarkoittaa, että seos on haihtuvampaa kuin komponentit sinänsä. Esimerkiksi kloroformi ja etanoli ovat tällainen seos.[1]
Lähteet muokkaa
- ↑ a b Thomas Engel & Philip Reid: Physical Chemistry, s. 200,214. Pearson International, 2006. ISBN 978-0-321-64305-6. (englanniksi)






